12. Общая характеристика реакционной способности пирролов, тиофенов и фуранов
В этой главе рассмотрены общие принципы реакционной способности пятичленных гетероциклических соединений — пирролов, тиофенов и фуранов, а также приведён сравнительный анализ реакционной способности представителей этого класса гетероциклических соединений.
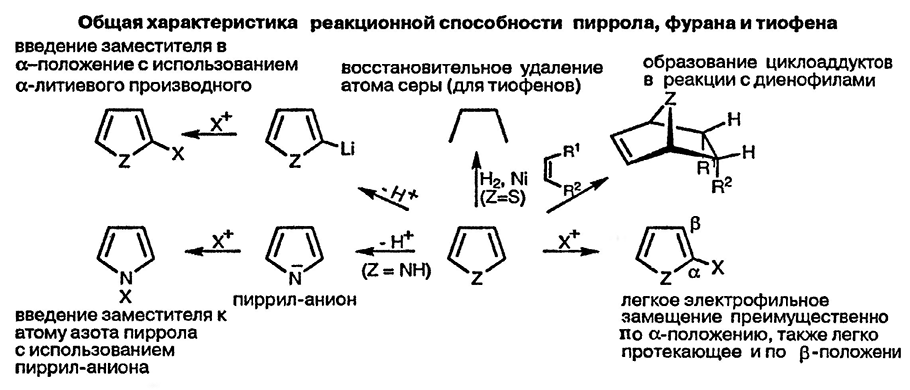
Основу химии пиррола, тиофена и фурана определяет способность этих соединений с лёгкостью вступать в реакции электрофильного замещения, преимущественно по α-положению. Электрофильное замещение по β-положению протекает менее легко и обычно в том случае, если α-положения заняты заместителями. На начальном этапе изучения химии гетероциклических соединений следует особо обратить внимание на существенное различие в реакционной способности пяти- и шестичленных гетероциклических соединений: первые реагируют с электрофилами легче, чем бензол, тогда как последние гораздо сложнее.
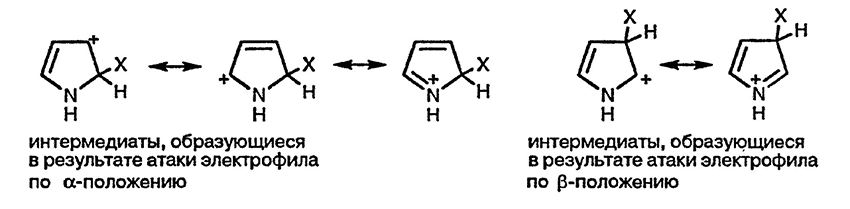
Региоселективность в реакциях пятичленных гетероциклических соединений с электрофилами, а также высокая реакционная способность гетероциклических соединений этого класса в таких реакциях, может быть объяснена при рассмотрении интермедиатов Виланда (родственных переходным состояниям, ведущим к их образованию). Присоединение электрофильной частицы как по α-, так и по β-положению приводит к образованию стабилизированных катионов (показано на схеме для пиррола).
Делокализация положительного заряда с участием электронов гетероатома в большей степени проявляется в интермедиатах, образующихся при атаке электрофила по α-положению, что наглядно демонстрируется большим числом низкоэнергетических резонансных форм. Следует также отметить, что в интермедиатах, образующихся при атаке электрофила по β-положению, резонансная стабилизация с участием двойной связи углерод — углерод невозможна.
При сравнении реакций с электрофилами пиррола и анилина легко обнаружить сходство их реакционных способностей
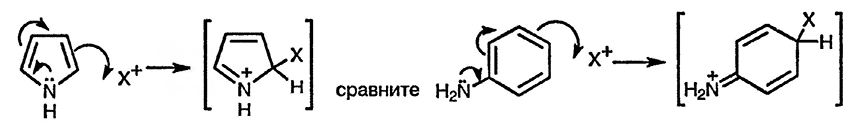
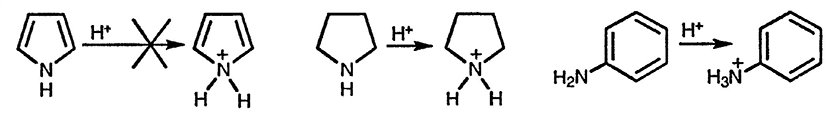
Пятичленные гетероциклические соединения не реагируют с электрофилами по гетероатому. Для начинающего изучать химию гетероциклических соединений этот факт может показаться удивительным. Действительно, как можно было бы ожидать, неподелённая электронная пара атома азота в пирроле должна легко взаимодействовать с электрофилами, как это происходит в случае пирролидина, полностью насыщенного аналога пиррола. Различие заключается в том, что присоединение электрофильной частицы по атому азота пиррола приводит к существенной потере в резонансной стабилизации — молекула превращается при таком взаимодействии в циклический бутадиен с присоединённым атомом азота и к тому же с локализованным положительным зарядом.
С учётом этого аналогия с анилином теряет всякий смысл, и действительно анилины легко реагируют с простыми электрофилами (например, протоном) по атому азота. Существенное различие заключается в том, что хотя при взаимодействии электрофила с атомом азота анилина и происходит некоторая потеря в стабилизации, связанной с перекрыванием неподелённой электронной пары азота с бензоидной π-электронной системой, сама бензоидная π-система остаётся неизменной.
Из пятичленных гетероциклических соединений (пиррол, фуран, тиофен) пиррол наиболее подвержен реакциям с электрофилами, что связано с большей электронодонорной способностью нейтрального трёхвалентного атома азота, а также с большей стабильностью положительно заряженного четырёхвалентного атома азота. Этот факт находит простое подтверждение при сравнении относительной основности насыщенных аминов, сульфидов и эфиров. Ряд основности прекрасно иллюстрирует относительную реакционную способность пиррола, фурана и тиофена по отношению к атаке электрофила по атому углерода и способность соответствующего гетероатома стабилизировать образующиеся при этом интермедиаты за счёт электронодонорной способности.
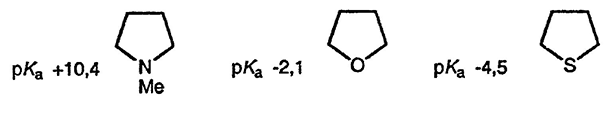
Количественно большую реакционную способность пиррола по сравнению с реакционными способностями фурана и тиофена можно проиллюстрировать большой скоростью реакции пиррола с катионом фенилдиазония и азотистой кислотой; ни фуран, ни тиофен в реакцию с этими электрофилами не вступают. Важно также отметить, что N,N-диметиланилин тоже легко реагирует с этими электрофильными реагентами, а анизол не реагирует.
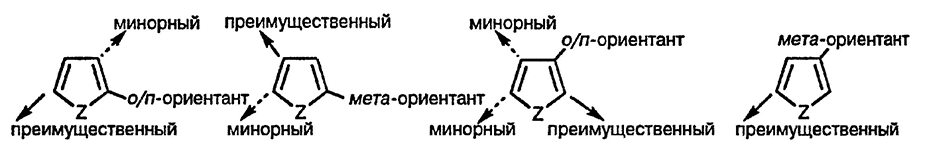
Заместители, уже имеющиеся в пятичленном гетероциклическом кольце, так же, как и в случае замещённых бензолов, обладают определённым ориентирующим действием. Например, алкильные группы способствуют атаке электрофила по орто- и пара-положениям, нитрогруппа — по мета-положению, хотя, строго говоря, эти термины не могут быть применены в случае пятичленных гетероциклических соединений. Склонность к преимущественному замещению по α-положению доминирует над направляющим влиянием заместителей во многих случаях, а продукты реакции замещения, образование которых обусловленно таким влиянием, обычно являются минорными по сравнению с продуктами замещения по свободному α-положению. Направляющее влияние заместителей менее всего проявляется в случае фурана.
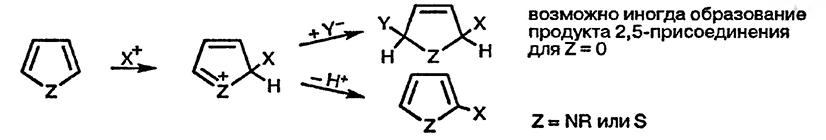
Существенное отличие реакций фурана с электрофильными реагентами состоит в том, что при этом иногда образуются продукты 2,5-присоединения. Образование таких продуктов инициируется первоначальной электрофильной атакой по α-положению, приводящей к обычному интермедиату Виланда, который в дальнейшем при наличии реакционноспособного нуклеофила не теряет протон, а превращается в продукт 2,5-присоединения. Обычно подбором определённых условий проведения реакции можно добиться образования «нормального» продукта α-замещения.
Эта особенность реакций фурана с электрофилами связана с низкой энергией резонансной стабилизации для фурана, что и определяет меньшую склонность интермедиата, образующегося в результате первоначального присоединения электрофильной частицы к фурану, восстанавливать ароматическую систему фурана в результате потери протона.
Пониженный ароматический характер фурана проявляется также в большей по сравнению с другими пятичленными гетероциклическими соединениями, такими, как пиррол и тиофен, склонности фурана вступать в реакции Дильса-Альдера в качестве диена. Пиррол и тиофен также могут участвовать в качестве диенов в реакции Дильса-Альдера, однако для успешного проведения таких реакций требуется либо повышенное давление, либо необходимо «понизить» ароматический характер цикла введением электроноакцепторной группы к атому азота пиррола.
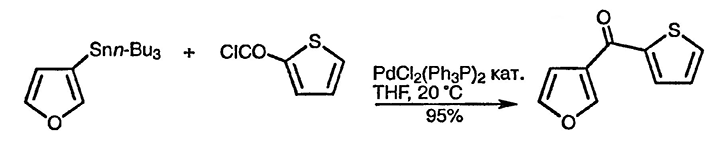
В противоположность электронодефицитным шестичленным гетероциклическим соединениям, подобным пиридину и диазинам, для пятичленных гетероциклических соединений не характерны реакции нуклеофильного замещения, за исключением тех случаев (особенно характерных для производных фурана и тиофена), когда атом галогена расположен в орто- или пара-положении по отношению к нитрогруппе. Для синтеза различных производных пятичленных гетероциклических соединений этой группы широко используются различные реакции сочетания, катализируемые палладием(0), как продемонстрировано ниже (см. разд. 2.7., где детально обсуждены такие процессы).
Чрезвычайно важное значение для синтеза различных производных пиррола, тиофена и фурана имеют реакции депротонирования. Фуран и тиофен депротонируются такими сильными основаниями, как н-бутиллитий и диизопропиламид лития, и при этом образуется α-анион, поскольку атом водорода в этом положении обладает подвижностью вследствие индуктивного электроноакцепторного влияния гетероатома. Полученный таким образом анион способен реагировать с самыми разнообразными электрофилами с образованием α-замещённых фуранов и тиофенов.
Эта методология существенно расширяет возможность использования процессов электрофильного замещения в синтезе различных производных фуранов и тиофенов, поскольку позволяет получать исключительно α-замещённые соединения, а также использовать даже слабые электрофильные реагенты. Использование металлированных N-замещённых пирролов также обеспечивает ценный синтетический подход к различным α-замещённым пирролам. При отсутствии заместителя при атоме азота депротонирование пиррола приводит к пиррил-аниону, который обладает нуклеофильными свойствами, и при его взаимодействии с электрофильными реагентами образуются производные индола, замещённые по атому азота.
Возможность взаимодействия электронодонорного гетероатома с положительным зарядом, локализованным в боковой цепи, особенно в α-положении цикла, обеспечивает ряд эффектов, наиболее важный из которых заключается в увеличении реакционной способности уходящей группы, расположенной в боковой цепи.
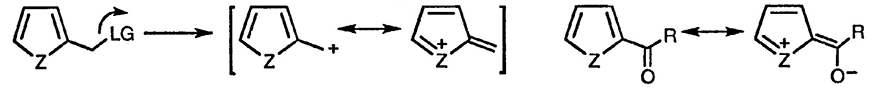
Подобное влияние гетероатома сказывается на карбонильных группах в α-положениях; приведённые резонансные структуры объясняют в некоторой степени меньшую активность карбонильных групп в таких соединениях.
Пятичленные гетероциклические соединения гораздо менее стабильны в окислительных условиях, чем бензоидные соединения, за исключением тиофенов; вообще тиофены по своим свойствам наиболее близки к карбоароматическим соединениям. Гидрирование тиофенов, в особенности с использованием никелевых катализаторов, приводит к восстановлению и удалению гетероатома. Для пирролов и фуранов известны некоторые контролируемые процессы восстановления, приводящие к образованию дигидропроизводным.
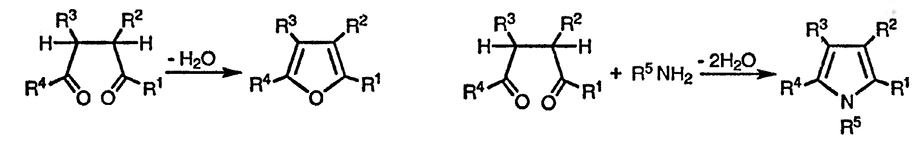
Методы синтеза пятичленных гетероциклических соединений интенсивно разрабатывались, что привело к созданию большого многообразия, в том числе и тонких, синтетических подходов. Каждый из представителей рассматриваемого класса гетероциклических соединений может быть получен из 1,4-дикарбонильных соединений в результате либо катализируемой кислотой циклодегидратации (в случае фурана), либо взаимодействия с аммиаком, первичными аминами или источником серы (в случае пиррола и тиофена соответственно).
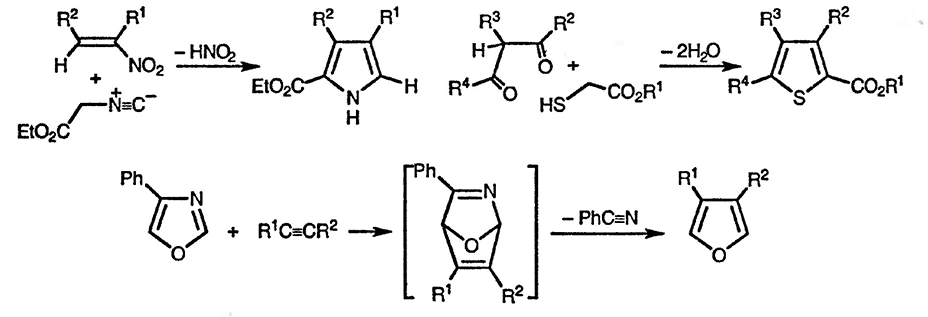
В качестве иллюстрации многообразия методов синтеза пятичленных гетероциклических соединений приведём три представленных ниже процесса: присоединение изонитрила к α,β-непредельному нитросоединению с последующим элиминированием азотистой кислоты; использование реакции эфиров тиогликолевой кислоты с 1,3-дикарбонильными соединениями для получения эфиров тиофен-2-карбоновых кислот; превращение изоксазола в фуран в результате реакции циклоприсоединения с последующей циклореверсией.
12. Общая характеристика реакционной способности пирролов, тиофенов и фуранов
Глава 12
- 12. Общая характеристика реакционной способности пирролов, тиофенов и фуранов
Дополнительно:
 Успехи химии и физики полимеров
Успехи химии и физики полимеров В сборник включены обзорные статьи по наиболее актуальным и интересным вопросам ...
 Химия в нашем доме
Химия в нашем доме Описаны самые разнообразные химические средства, применяемые в быту для стирки, ...
 Электронные корреляции в молекулах
Электронные корреляции в молекулах В книге автора из Великобритании излагаются современные методы теоретической ...
 Комплексы 4d-платиновых металлов с фосфор(III)- и мышьяк(III)- органическими лигандами
Комплексы 4d-платиновых металлов с фосфор(III)- и мышьяк(III)- органическими лигандами В монографии проанализированы и обобщены данные по условиям стабилизации ...