2.6.1.3. Литиирование пятичленных гетероциклических соединений
Индуктивное влияние гетероатома, оттягивающего электронную плотность, проявляется в большей степени в α-положении, что позволяет проводить прямое α-литиирование практически всех пятичленных гетероциклических соединений. Относительная кислотность α-Н-атомов некоторых различных гетероциклических соединений приведена ниже.

Равновесные значения рКа для некоторых пятичленных гетероциклических соединений при депротонировании в ТГФ [69] (измеряемые значения pKa варьируются в зависимости от природы растворителя).
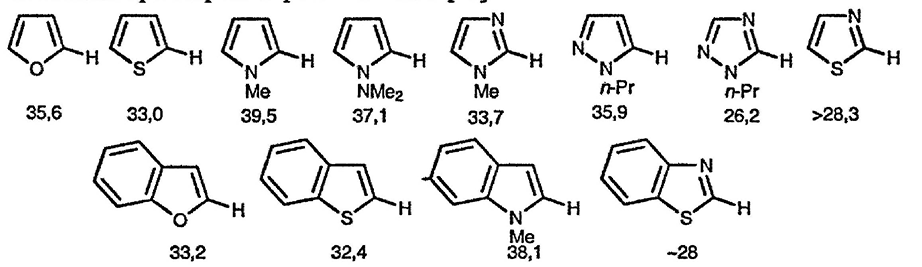
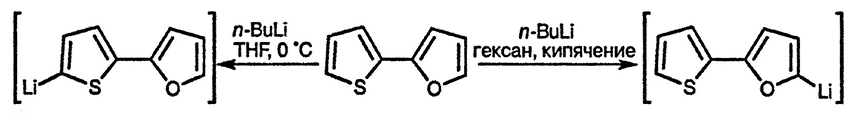
Несмотря на низкую электроотрицательность атома серы и соответственно более слабый индуктивный эффект, проявляемый этим гетероатомом, тиофены способны металлироватся с той же лёгкостью, что и фураны. Связано это с большей поляризуемостью атома серы, что способствует большему распределению отрицательного заряда в анионе [70], хотя участие d-орбитали в стабилизации анионного центра не очень существенно. Направление литиирования 2-(2-фурил)тиофена зависит от условий [71] проведения процесса: в неполярных растворителях литиирование преимущественно идёт по фурановому циклу, поскольку литий сильно координирован по атому кислорода, что приводит к увеличению индуктивного эффекта этого гетероатома
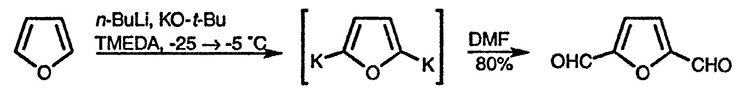
Использование более сильного основания может приводить к образованию диметаллопроизводных [72]
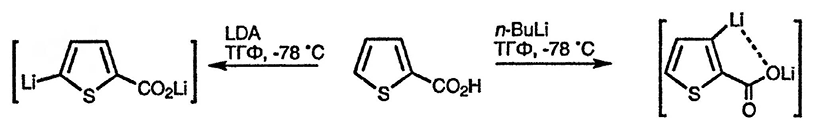
Влияние направляющих групп может нарушать свойственную пятичленным гетероциклическим соединениям α-селективность литиирования, как это показано в приведённом ниже примере для тиофена, однако использование диизопропиламида лития позволяет осуществить процесс литиирования «обычным» образом [73]
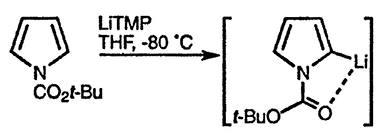
Литиирование пиррола осложняется в присутствии более подвижного атома водорода, связанного с атомом азота; так, 1-метилпиррол литиируется по положению C(2), хотя и в более жёстких условиях, чем фуран [74]. Введение удаляемой защитной группы в положение 1 пиррола позволяет получать α-литиевые производные. Для этих целей может быть использовано трет-бутилоксикарбонильная группа, преимущество которой связано не только с лёгкой удаляемостью в результате гидролиза, но и с её электроноакцепторными свойствами, повышающими кислотность α-Н-атома. Кроме того, трет-бутилоксикарбонильная группа способствует литиированию за счёт хелатирования [75].
Литиирование бензо[b]тиофенов, бензо[b]фуранов и индолов, содержащих защитную группу в положении 1, идёт по α-положению относительно гетероатома [76]. Литиирование в другие положения гетероциклической системы возможно в результате реакций обмена, однако при повышенных температурах такие литиевые производные склонны изомеризоваться в 2-литийпроизводные [68].
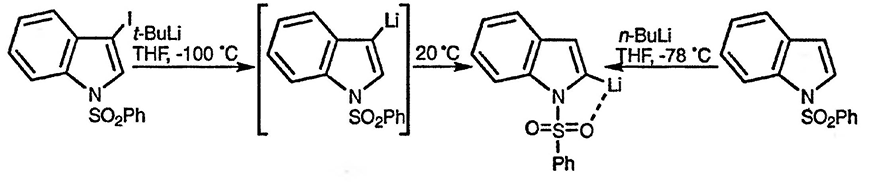
Литиирование по бензольному кольцу может быть достигнуто при реакции обмена даже без предварительной защиты NH-группы в случае индола, то есть с образованием N,C-дилитийпроизводных [77].
Литиирование 1,3-азолов осуществляется очень легко по положению C(2). Лёгкость такого металлирования обусловлена одновременно двумя факторами, повышающими кислотность атома водорода в этом положении: индуктивным и мезомерным электроноакцепторным влиянием «пиридинового» атома азота (разд. 2.6.1.4.) и индуктивным электроноакцепторным влиянием второго гетероатома, аналогичным тому, которое проявляется в тиофене, фуране и пирроле. При наличии заместителя в положении 2 литиирование 1,3-азолов обычно идёт по положению 5 [78].

При литиировании имидазола первоначально необходимо введение защитной группы к атому азота N(1). В качестве защитной обычно используют группу, которая обеспечивает дополнительную стабилизацию образующегося аниона и увеличивает селективность α-литиирования вследствие координации иона лития; одна из таких групп — триметилсилилэтоксиметильная [Me3Si(CH22OCH2, SEM] [80].
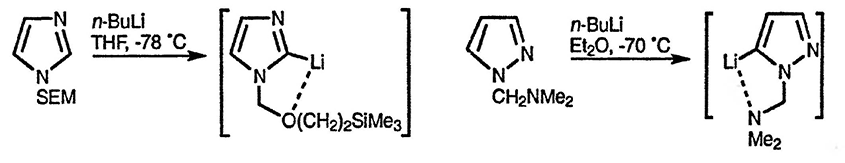
Существенно, что пиразол, содержащий защитную группу у атома N(1), литиируется по положению 5, то есть по положению, соседнему с «пиррольным» атомом азота; такое же направление литиирования наблюдается при наличии в положении N(1) группы, способной содействовать металлированию в результате хелатирования [81].
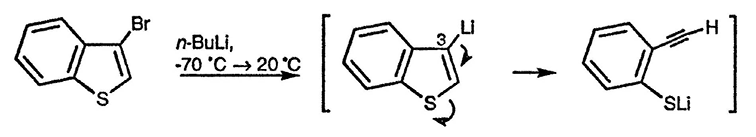
При литиировании пятичленных гетероциклических систем по β-положению [82] возможно раскрытие гетероцикла при повышении температуры, гетероатом в этом случае выступает в роли уходящей группы [83].
2.6.1.3. Литиирование пятичленных гетероциклических соединений
Список литературы к главе 2
Глава 2
- 2. Реакционная способность ароматических гетероциклических соединений
- 2.1. Реакции электрофильного присоединения к атому азота
- 2.2. Реакции электрофильного замещения при атому углерода
- 2.2.1. Механизм ароматического электрофильного замещения
- 2.2.2. Шестичленные гетероциклические соединения
- 2.2.3. Пятичленные гетероциклические соединения
- 2.3. Реакции нуклеофильного замещения при атоме углерода
- 2.3.1. Механизм реакции ароматического нуклеофильного замещения
- 2.3.2. Шестичленные гетероциклические соединения
- 2.3.3. Викариозное нуклеофильное замещение
- 2.4. Реакции радикального замещения при атоме углерода
- 2.4.1. Реакции гетероциклических соединений с нуклеофильными радикалами. Реакция Минисци
- 2.4.2. Реакции с электрофильными радикалами
- 2.5. Депротонирование атома азота
- 2.6. Металлоорганические производные
- 2.6.1. Литийорганические производные
- 2.6.1.1. Прямое литиирование (депротонирование при атоме углерода)
- 2.6.1.2. Обмен атома галогена
- 2.6.1.3. Литиирование пятичленных гетероциклических соединений
- 2.6.1.4. Литиирование шестичленных гетероциклических соединений
- 2.6.2. Магнийорганические производные
- 2.6.3. Бор-, кремний- и оловоорганические реагенты
- 2.6.3.1. Синтез
- 2.6.3.2. Реакции
- 2.6.4. Цинкорганические производные
- 2.6.5. Металлирование боковой цепи шестичленных гетероциклических соединений («латеральное металлирование»)
- 2.6.6. Металлирование боковой цепи пятичленных гетероциклических соединений
- 2.7. Реакции, катализируемые палладием
- 2.7.1. Основные процессы с участием палладийорганических соединений
- 2.7.1.1. Согласованные реакции
- 2.7.1.2. Ионные реакции
- 2.7.2. Реакции, катализируемые палладием, в химии гетероциклических соединений
- 2.7.2.1. Реакция Хека
- 2.7.2.2. Реакции сочетания
- 2.7.2.3. Реакции карбонилирования
- 2.7.2.4. Синтез бензоконденсированных гетероциклических соединений
- 2.8. Окисление и восстановление гетероциклических соединений
- 2.9. Биологические процессы в химии гетероциклических соединений
Дополнительно:
В книге даётся богатейший, хорошо систематизированный справочный материал по ...
Книга представляет собой материалы XVII Международного конгресса по теоретической ...
В книге рассматриваются основы методов определения геометрического строения ...
 Биографии великих химиков
Биографии великих химиков В книгу, написанную коллективом авторов из ГДР, включены биографические очерки о ...