26.1.1.3. Тетразол
Величины pKa для тетразола и карбоновых кислот подобны, поэтому тетразолы часто используют в качестве биоэквивалентов карбоксильной группы в биологически активных соединениях [28]. Тетразол и его алкильные и арильные производные обычно в значительной степени разлагаются при температуре около 180 °C, а хлор- и алкилтиопроизводные разлагаются при более низких температурах; 5-нитротетразол непредсказуемо взрывается при хранении [29].
Тетразолы алкилируются и ацилируются по положениям N(1) и N(2) в зависимости от природы заместителя в положении 5, однако возможно проведение селективного 1-алкилирования при кватернизации 2-три-н-бутилстан-нил- и 2-три-н-бутилпроизводных [30]. К сожалению, в последнем случае кватернизацию не удаётся провести с использованием алкилгалогенидов и необходимо применение алкилсульфатов или более сильных алкилирующих агентов [31].
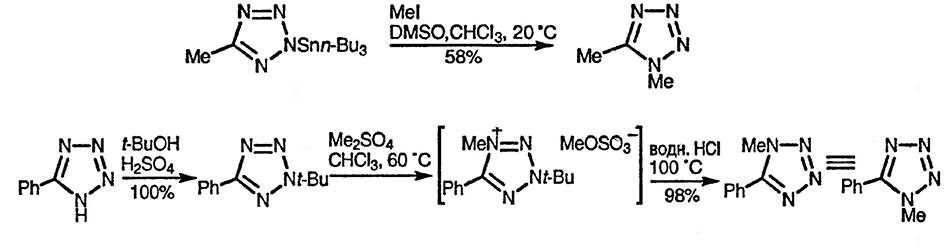
Замечательно то, что можно осуществить некоторые реакции C-электрофильного замещения, такие, как бромирование [32], меркурирование [33] и даже реакцию Манниха [34] (но не нитрование), хотя механизм этих процессов отличается от обычного.
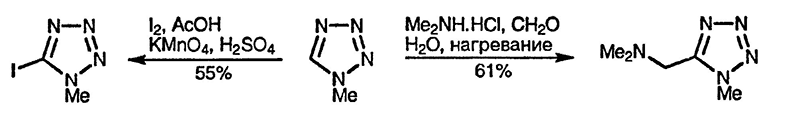
Как и следовало ожидать, благодаря индуктивным эффектам 5-бром-1-метилтетразол более активен в реакциях нуклеофильного замещения, чем соответствующие галогено-1,2,4- и галогено-1,2,3-триазолы, которые, в свою очередь, обладают большей реакционной способностью, чем соответствующие галогени-мидазолы. 5-Бром-2-метилтетразол значительно менее реакционноспособен, чем его 1-метилизомер из-за менее эффективной делокализации отрицательного заряда в промежуточно образующемся аддукте [35].
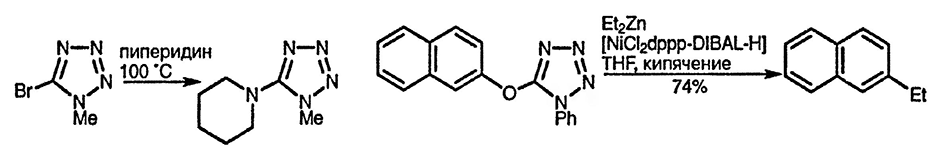
5-Тетразолиловые эфиры могут быть использованы либо для активации фенолов в катализируемых никелем и палладием реакциях сочетания, как показано выше, либо для осуществления каталитического гидрогенолиза связи C-O фенола [36].
C-Литиирование происходит легко, а образующиеся литиевые производные могут вступать в реакции с электрофилами, несмотря на сильную склонность к циклореверсии. Тетразол может выступать также в качестве орто-ориентирующей группы, как это происходит при литиировании 5-фенилтетразола [37] [38]. Тетразолиловый эфир также служит орто-ориентантом в реакциях металлирования, но в этом случае происходит миграция тетразольного фрагмента от атома кислорода клишированному атому углерода [39]. n-Метоксибензильная группа служит хорошей защитной группой для атома азота в реакции литиирования и, в конечном итоге, может быть удалена гидрогенолизом или окислением, как показано ниже [40]:
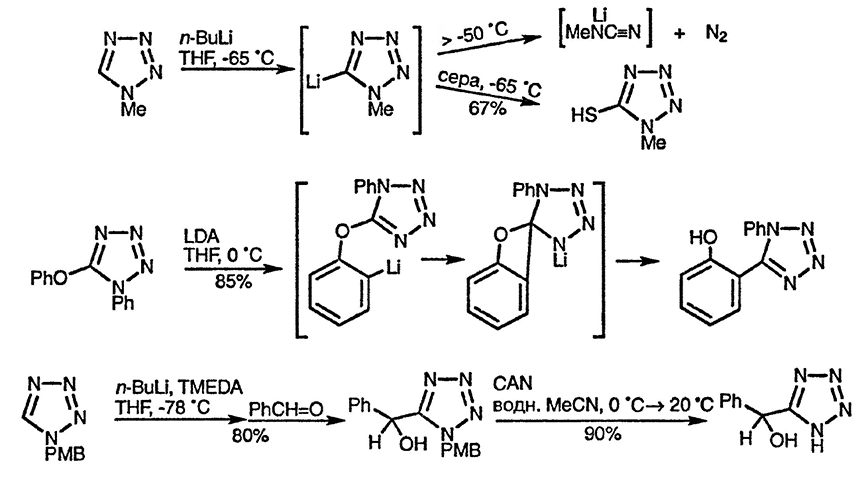
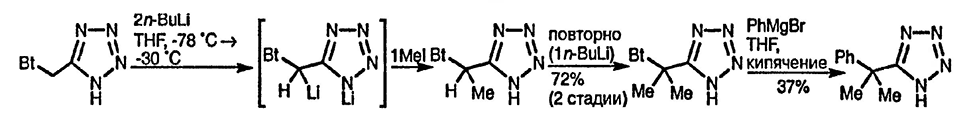
5-Алкильные группы в 1-замещённых тетразолах можно литиировать, однако в 5-алкил-2-метилтетразоле металлирование идёт по N-метильной группе [41], а 5-метил-2-тритилтетразол литиируется обычно по метальной группе боковой цепи [42]. Метиленовая группа в 5-(бензотриазолилметил)тетразоле достаточно активирована, поэтому нет необходимости в N-защитной группе — бензотриазол может впоследствии выступать в качестве уходящей группы при замещении реагентами Гриньяра, как показано ниже [43]:
5-Аминотетразол образует соль диазония (с брутто-формулой CN6*HCl!) (ОСТОРОЖНО: ВЗРЫВООПАСНО), которую можно использовать для генерирования атомного углерода [44]! 1-Замещённые 5-аминотетразолы, по-видимому, образуют относительно устойчвые N-нитрозопроизводные.
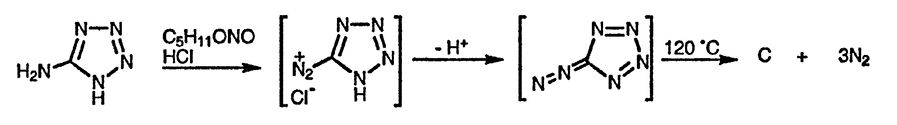
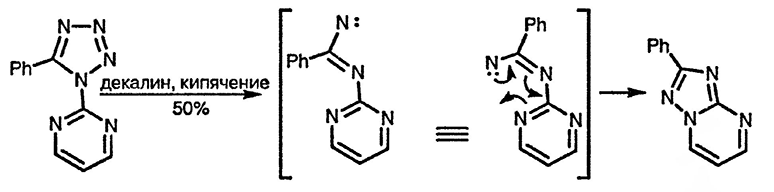
При вакуумном пиролизе в тонком слое 5-арилтетразолы генерируют арил-карбены, а при нагревании пиримидинилфенилтетразола, как показано ниже, в кипящем декалине (180 °C) образуется нитреновый интермедиат, и нитренный атом азота затем при циклизации становится пиримидиновым атомом азота [46].
При окислении гипобромитом 5-бензиламинотетразолов образуются полезные бензилизонитрилы, как показано ниже [47]:
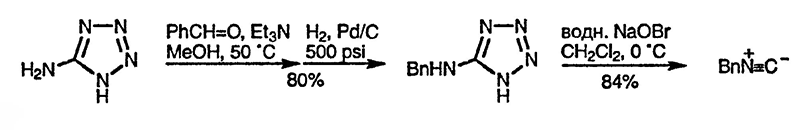
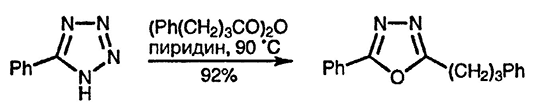
1,3,4-Оксадиазолы получаются при нагревании тетразолов с ацилирующими агентами в результате перегруппировки первоначально образующихся 2-ацил-производных [48]
Глава 26
- 26. Гетероциклы, содержащие более двух гетероатомов
- 26.1. Пятичленные циклы
- 26.1.1. Азолы
- 26.1.1.1. 1,2,3-Триазол
- 26.1.1.2. 1,2,4-Триазол
- 26.1.1.3. Тетразол
- 26.1.1.4. Синтез циклической системы азолов
- 26.1.2. Оксадиазолы и тиадиазолы
- 26.1.3. Другие системы
- 26.1.4. Синтезы кольца
- 26.1.4.1. 1,2,4-Оксадиазолы
- 26.1.4.2. 1,3,4-Оксадиазолы
- 26.1.4.3. 1,2,5-Оксадиазолы
- 26.1.4.4. Сидноны
- 26.1.4.5. 1,2,3-Тиадиазолы
- 26.1.4.6. 1,2,4-Тиадиазолы
- 26.1.4.7. 1,3,4-Тиадиазолы
- 26.1.4.8. 1,2,5-Тиадиазолы
- 26.2. Шестичленные циклы
- 26.2.1. Азины
- 26.2.2. Синтезы кольца
- 26.2.2.1. 1,2,3-Триазин
- 26.2.2.2. 1,2,4-Триазины
- 26.2.2.3. 1,3,5-Триазины
- 26.2.2.4. 1,2,4,5-Тетразины
- 26.3. Бензотриазолы
Дополнительно:
В справочник включены сведения об органических стабилизаторах, ускорителях и ...
 Лабораторный практикум по синтетическим каучукам
Лабораторный практикум по синтетическим каучукам В книге описаны приёмы работы, техника эксперимента, основные приборы и ...
Книга бельгийской исследовательницы, ученицы и сотрудницы лауреата Нобелевской ...