26.1.2. Оксадиазолы и тиадиазолы
Только один двухвалентный гетероатом может участвовать в построении пятичленного ароматического гетероцикла. В названии таких соединений нумерацию начинают от неазотного гетероатома, а положения атомов азота определяют по отношению к двухвалентному гетероатому.
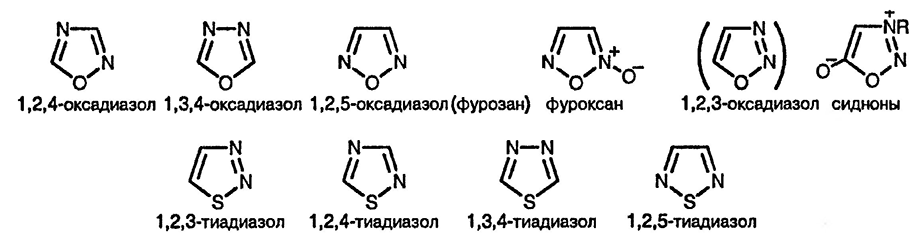
1,2,4- [70], 1,3,4- [71] и 1,2,5-оксадиазолы хорошо известны, а система 1,2,3-оксадиазола, расчёты для которой показывают, что она относительно неустойчива по сравнению с её ациклическим диазокетонным таутомером [72], известна только в виде бензаннелированного производного (в растворе) и в виде мезоионных соединений «сиднонов» [73], которые хорошо исследованы. «Фуроксаны» [74], образующиеся при димеризации нитрилоксидов, также широко изучены. 1,2,3-, 1,2,4- [75], 1,3,4- [76] и 1,2,5-тиадиазолы [77] — все хорошо охарактеризованы. Данные по ароматичности, рассчитанные на основании спектров ЯМР, позволяют расположить соединения в следующем порядке [78]:
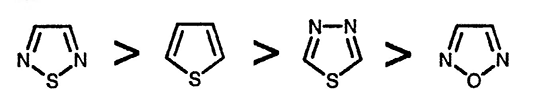
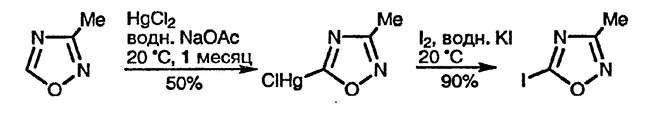
Как и в случае азолов, окса- и тиадиазолы — очень слабые основания, что обусловлено индуктивными эффектами дополнительных гетероатомов, хотя их можно кватернизовать по атому азота. По тем же причинам реакции электрофильного замещения по атому углерода практически неизвестны, за исключением некоторых реакций галогенирования и меркурирования [79]. Интригующий парадокс заключается в том, что обычно меркурирующие агенты считаются слабыми электрофилами, и тем не менее они часто успешно реагируют с электронодефицитными гетероциклами. Другое важное отличие от азолов заключается в отсутствии N-водородных атомов, поэтому реакции, протекающие через промежуточное образование N-анионов, для этих систем невозможны.
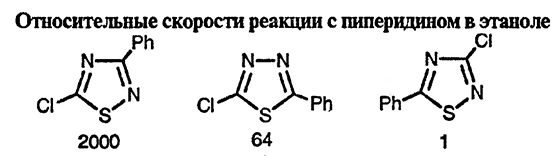
Все эти системы чувствительны к нуклеофильным атакам, особенно оксадиазолы, которые часто претерпевают раскрытие цикла под действием водной кислоты или основания; исключение составляют случаи, когда при обоих атомах углерода имеются заместители. Аналогично уходящие группы обычно легко замещаются; существуют значительные отличия в реакционной способности положений: в 1,2,4-окса- и 1,2,4-тиадиазолах атом хлора в положении 5 замещается гораздо легче, чем в положении 3, что, без сомнения, обусловлено более эффективной стабилизацией образующегося в первом случае промежуточного анионного аддукта. Это далеко не полные сведения, позволяющие сравнивать относительную реакционную способность, однако некоторые данные все же доступны [80].
В условиях основного катализа обмен протона происходит легко, но зачастую он конкурирует [81] с процессом разложения в результате циклореверсии или β-элиминирования в анионе. Прямое литиирование по атому углерода идёт легко [82], однако образующиеся литиевые производные различаются по своей устойчивости, поэтому некоторые из них не находят препаративного применения [83]. Атомы водорода боковых алкильных групп обладают СН-кислотностью за счёт того, что в депротонированных частицах происходит делокализация заряда с участием кольцевых атомов азота. В связи с этим существует интересное различие между 1,2,5-окса- и 1,2,5-тиадиазолами: в первом случае металлирование идёт при взаимодействии с н-бутиллитием, а во втором — необходимо использовать диизопропиламид лития для предотвращения конкурентного нуклеофильного присоединения по атому серы, приводящего к раскрытию цикла [84]:
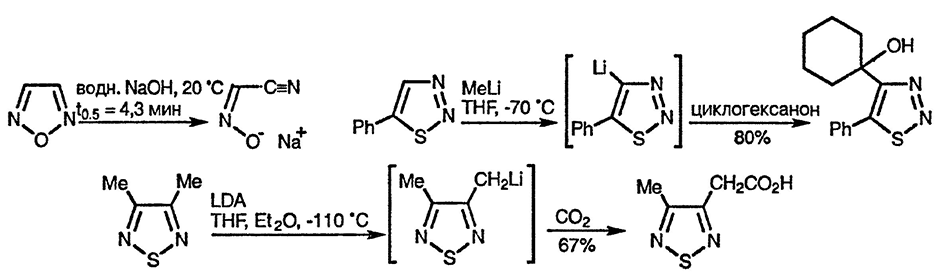
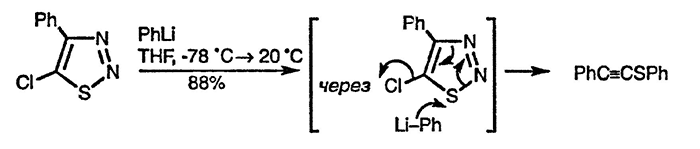
4-Замещённые 5-хлор-1,2,2-тиадиазолы вступают в реакции с простыми гетеронуклеофилами и при этом происходит замещение атома хлора. Однако при взаимодействии с арил- и алкиллитиевыми производными образуются алкинил-тиоэфиры в результате атаки по атому серы с последующей потерей азота и разрушением цикла. Подобное раскрытие цикла, но по другому механизму, наблюдается при обработке основанием 5-незамещённого аналога [85].
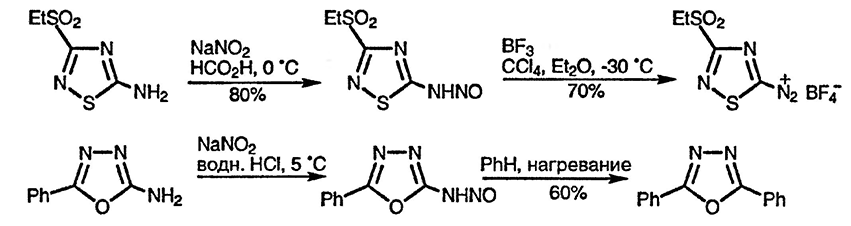
Обычно амины могут быть продиазотированы и превращены, например, в галогениды, но в некоторых случаях промежуточно образующиеся N-нитрозопроизводные устойчивы и превращаются в соль диазония только при обработке сильной кислотой, что, по-видимому, обусловлено более низкой стабилизацией положительно заряженной группы, присоединённой к электронодефицитному циклу [86]
Интересный и совершенно общий тип реакций для таких циклических систем заключается во взаимопревращении циклов в результате внутримолекулярной атаки по атому азота [87].

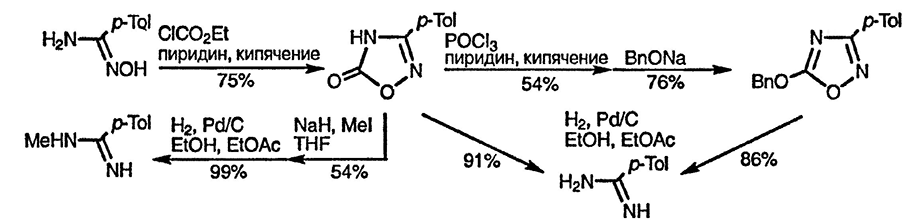
1,2,4-Оксадиазолы используют как замаскированные амидины в тех случаях, когда подобные сильноосновные группы несовместимы с условиями реакции — амидин легко высвобождается при гидрогенолизе, как показано ниже [88]:
Глава 26
- 26. Гетероциклы, содержащие более двух гетероатомов
- 26.1. Пятичленные циклы
- 26.1.1. Азолы
- 26.1.1.1. 1,2,3-Триазол
- 26.1.1.2. 1,2,4-Триазол
- 26.1.1.3. Тетразол
- 26.1.1.4. Синтез циклической системы азолов
- 26.1.2. Оксадиазолы и тиадиазолы
- 26.1.3. Другие системы
- 26.1.4. Синтезы кольца
- 26.1.4.1. 1,2,4-Оксадиазолы
- 26.1.4.2. 1,3,4-Оксадиазолы
- 26.1.4.3. 1,2,5-Оксадиазолы
- 26.1.4.4. Сидноны
- 26.1.4.5. 1,2,3-Тиадиазолы
- 26.1.4.6. 1,2,4-Тиадиазолы
- 26.1.4.7. 1,3,4-Тиадиазолы
- 26.1.4.8. 1,2,5-Тиадиазолы
- 26.2. Шестичленные циклы
- 26.2.1. Азины
- 26.2.2. Синтезы кольца
- 26.2.2.1. 1,2,3-Триазин
- 26.2.2.2. 1,2,4-Триазины
- 26.2.2.3. 1,3,5-Триазины
- 26.2.2.4. 1,2,4,5-Тетразины
- 26.3. Бензотриазолы
Дополнительно:
 Откровенная наука. Беседы с корифеями биохимии и медицинской химии
Откровенная наука. Беседы с корифеями биохимии и медицинской химии Книга И. Харгиттаи состоит из 36 бесед с выдающимися учёными XX века, работавшими в ...
Книга, написанная известным американским учёным, представляет собой руководство ...
 Стереохимия производных циклогексана
Стереохимия производных циклогексана Москва, 1958 год. Издательство иностранной литературы. Издательский переплёт. ...
В книге рассматриваются строение, свойства и особенности переработки ...