21.11. Четвертичные соли 1,3-азолов
Гексафторофосфат 1-бутил-3-метилимидазолия, жидкий при комнатной температуре и устойчивый по отношению к воде, рекомендован в качестве «ионной жидкости» и, как показано, служит эквивалентом диполярного апротонного растворителя в некоторых катализируемых основаниями процессах алкилирования; продукты реакции можно легко выделить экстракцией несмешивающимися органическими растворителями обычным образом [109].
N-Ацилоксикарбонил-1,3-азолиевые соли, генерируемые in situ реакцией с хлороформиатами, реагируют с аллилстаннанами [110] или аллилсиланами [111], присоединяя эквивалент аллил-аниона. Аналогично силиловые эфиры енола присоединяют эквивалент енолята с образованием 2,3-дигидро-2-замещённых имидазолов и тиазолов [112].
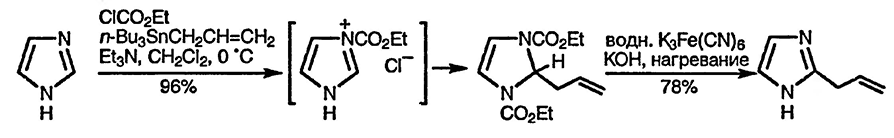
Азолиевые соли быстро атакуются нуклеофилами, например гидроксид-ионом, и присоединение происходит по положению 2 с последующим раскрытием цикла [113]
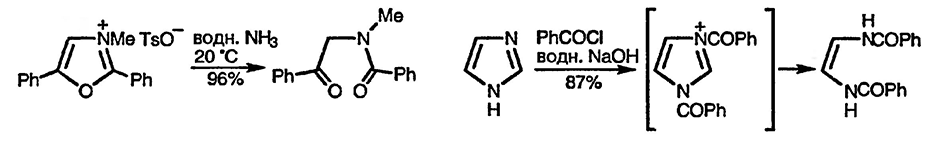
Осторожное использование этого процесса позволяет синтезировать гетероциклы среднего размера — продукты трёхстадийной последовательности превращений, а именно: присоединение гидроксид-иона к со-иодалкилтиазолиевым солям, раскрытие цикла и последующая повторная циклизация в результате внутримолекулярного S-алкилирования, как показано ниже на примерах образования восьмичленного цикла [114], и введение атома серы в положение 2 имидазола с использованием фенилхлортионоформиата [115]:
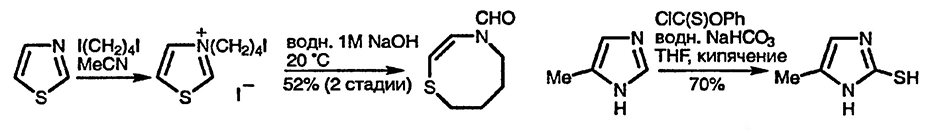
Обмен водорода в положении 2 азолиевых солей по илидному механизму был обсуждён в разд. 21.1.2.1. Пирофосфат тиамина участвует в некоторых биохимических процессах в качестве кофермента, и при этом характер его действия зависит от промежуточно образующихся 2-депротонированных частиц. Например, на последних стадиях ферментативного алкоголиза, когда происходит превращение глюкозы в этанол и CO2, фермент пируватдегидрогеназа превращает пируват в этаналь и CO2, затем этаналь под действием фермента алкоксидегидрогеназы переходит в этанол. Полагают, что при действии первого фермента кофермент-тиаминпирофосфат — присоединяется в виде илида по кетонной карбонильной группе пирувата с последующей потерей CO2 и высвобождением этаналя с выделением первоначального илида.
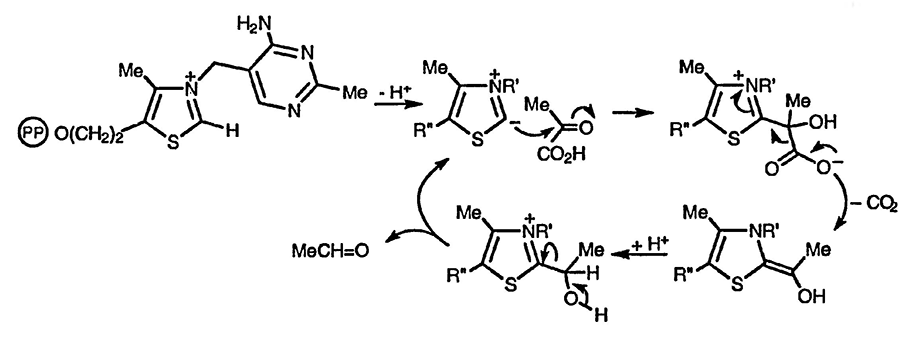
В лабораторных условиях соли тиазолия [хлорид 3-бензил-5-(2-гидрокси-этил)-4-метилтиазолия коммерчески доступен] используют в качестве катализаторов для бензоиновой конденсации. В противоположность цианиду, классическому катализатору для ароматических альдегидов, он позволяет проводить подобные реакции и с алифатическими альдегидами; ключевые стадии катализа ионом тиазолия при синтезе 2-гидроксикетонов показаны ниже. Такой катализатор, который также находит и другие применения, позволяет в действительности получать ацил-анионы.
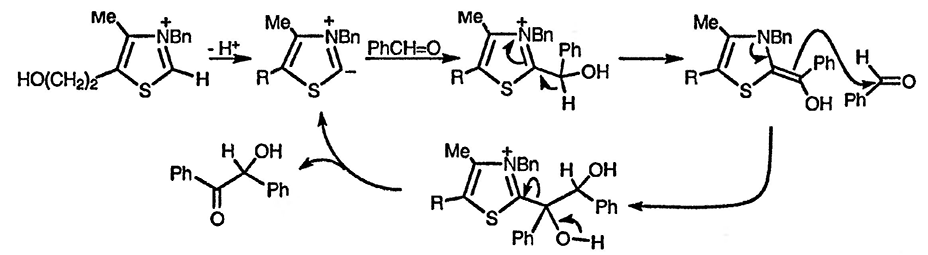
Интересен тот факт, что при замене тиазолиевого цикла на оксазолиевый получают аналог тиамина, не проявляющий каталитической активности [116]; аналогично иодид 3,4-диметилоксазолия не катализирует ацилоиновую конденсацию [117]. Природа выбирает гетероциклическую систему с правильным равновесием — илиды оксазолия образуются быстрее, но из-за их более высокой стабильности не происходит дальнейшего присоединения по карбонильной группе, которое требуется для проявления каталитической активности. В соответствии с карбеноидным характером тиазолиевых илидов происходит их димеризация; димеры как таковые или при превращении их в мономеры также катализируют бензоиновую конденсацию [118].
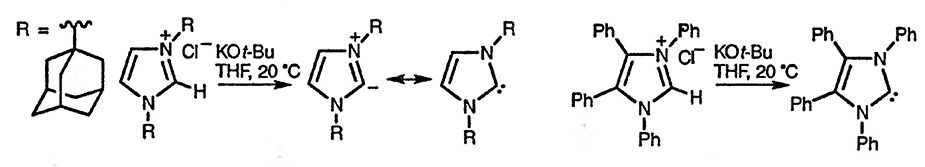
Илид 1,3-диметилимидазолия, генерируемый при использовании гидрида натрия, позволяет вводить электрофильные заместители в положение 2 [119]. Выделяемые кристаллические карбены получают из хлоридов 1,3-бис(адамантанил)имидазолия [120] и 1,3,4,5-тетрафенилимидазолия [121]. Стабильный тиазол-2-илиден содержит метильные группы в положениях 4 и 5 и 2,6-диизопропилфенильный заместитель при атоме азота [122].
Глава 21
- 21. 1,3-азолы — имидазолы, тиазолы и оксазолы: реакции и методы синтеза
- 21.1. Реакции с электрофильными реагентами
- 21.1.1. Присоединение по атому азота
- 21.1.1.1.1. Протонирование
- 21.1.1.2. Алкилирование по атому азота
- 21.1.1.3. Ацилирование по атому азота
- 21.1.2. Замещение по атому углерода
- 21.1.2.1. Протонирование
- 21.1.2.2. Нитрование
- 21.1.2.3. Сульфирование
- 21.1.2.4. Галогенирование
- 21.1.2.5. Ацилирование
- 21.1.2.6. Реакции с альдегидами
- 21.1.2.7. Реакции с иминиевыми солями
- 21.2. Реакции с окислителями
- 21.3. Реакции с нуклеофильными реагентами
- 21.3.1. Реакции с раскрытием цикла
- 21.3.2. Реакции замещения атома галогена
- 21.4. Реакции с основаниями
- 21.4.1. Депротонирование группы NH
- 21.4.2. Депротонирование СН
- 21.5. Реакции N-металлированных имидазолов
- 21.6. Реакции C-металлированных 1,3-азолов
- 21.6.1. Литийорганические производные
- 21.6.2. Реакции, катализируемые палладием
- 21.7. Реакции со свободными радикалами
- 21.8. Реакции с восстановителями
- 21.9. Электроциклические реакции
- 21.10. Алкил-1,3-азолы
- 21.11. Четвертичные соли 1,3-азолов
- 21.12. Гидрокси- и амино-1,3-азолы
- 21.13. N-оксиды 1,3-азолов
- 21.14. Синтезы 1,3-азолов
- 21.14.1. Синтез кольца
- 21.14.1.1. Из α-галогенокарбонильных соединений (или их эквивалентов) и трёхатомного фрагмента, поставляющего два гетероатома и атом C(2) кольца
- 21.14.1.2. Циклодегидратацией α-ациламинокарбонильных соединений
- 21.14.1.3. Из изонитрилов
- 21.14.1.4. Оксазолы из α-диазокарбонильных соединений
- 21.14.1.5. Дегидрированием
- 21.14.2. Примеры некоторых важных синтезов с участием 1,3-азолов
- 21.14.2.1. 4(5)-Фторгистамин
- 21.14.2.2. Пиридоксин
- 21.14.2.3. Тиамин
- 21.14.2.4. Тиено[2,3-d]имидазол
- 21.14.2.5. Гроссуларин-2
Дополнительно:
В книге, входящей в серию «Полимерные материалы в народном хозяйстве», изложены ...
В монографии рассмотрено фазообразование в сульфатно-фторидных водных системах ...
«Справочник по химии» предназначен для учащихся 7-10 классов. Он содержит сведения ...
