15.8. Электроциклические реакции (основного состояния)
Фуран вступает в реакции [4 + 2]-циклоприсоединения с такими мощными диенофилами, как, например, малеиновый ангидрид [73], и эта реакция была одним из наиболее ранних описанных примеров реакции Дильса-Альдера [74]. Выделенный аддукт представляет собой экзо-изомер [75], как было показано, он является термодинамическим продуктом, тоща как эндо-изомер — кинетический продукт, а процесс циклоприсоединения легко обратим [76].
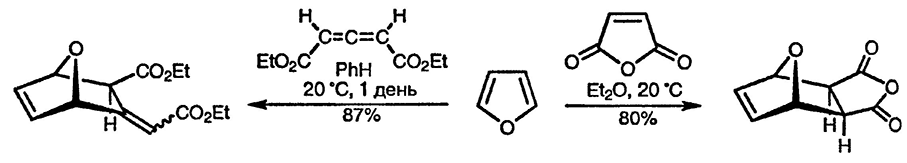
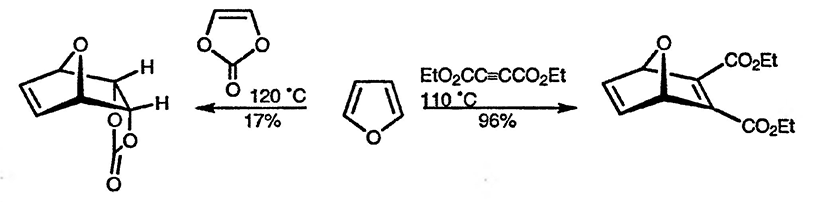
Фуран также вступает в реакцию циклоприсоединения с алленами [77] и с такими простейшими диенофилами, как акрилонитрил и акрилат (особенно в присутствии иодида цинка) [78], а также с эфирами малеиновой и фумаровой кислот при проведении реакции при высоком давлении [79]. Этот приём также может быть использован для заметного увеличения реакционной способности 2-метоксифурана и 2-ацетоксифурана в отношении диенофилов [80]. Катализ кислотами Льюиса также существенно ускоряет реакции Дильса-Альдера с участием фурана [81]. При проведении реакций при высоких температурах алкины [82] и даже электроноизбыточные алкены [83] присоединяются к фурану.
Очевидно, что 2-формилфуран менее эффективен в качестве электроноизбыточного диена в нормальной реакции Дильса—Альдера, чем соответствующий диметилгидразон, хотя в последнем случае образуются только производные бензола в результате раскрытия цикла [84].
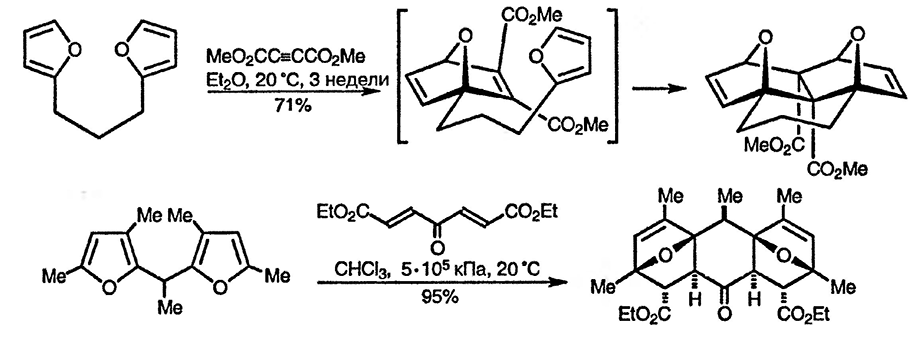
Существует много примеров использования реакции Дильса-Альдера с участием фурана для построения сложных структур [85]; два наиболее ярких примера приведены ниже. В первом из них первоначально образуется аддукт Дильса-Альдера в результате взаимодействия одного из фурановых колец с диметилацетилендикарбоксилатом, а оставшаяся диенофильная двойная связь аддукта вступает затем в реакцию циклоприсоединения ещё с одним фурановым кольцом [86]. Во втором примере из другой молекулы, содержащей два фурановых цикла, и соединения с двумя диенофильными двойными связями образуется сложное пентациклическое соединение, родственное природным [87].
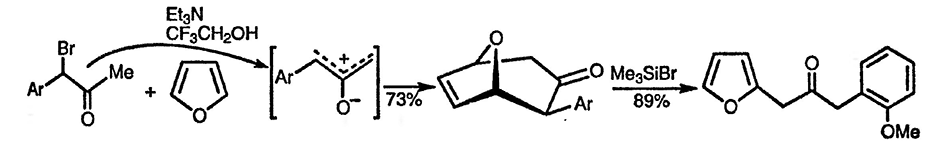
Циклоприсоединение 2-оксиаллильных катионов [88] также широко используется для синтеза замещённых фуранов и полициклических соединений [89]. В качестве примера можно привести введение ацетилметильных групп в α-положение фурана [90].
Описано много примеров участия фурана во внутримолекулярных реакциях Дильса-Альдера [90]. Пример, приведённый ниже, показывает, что такие реакции могут протекать в довольно мягких условиях [92]. Даже неактивированные алкены могут вступать во внутримолекулярные реакции Дильса-Альдера с фураном [93].
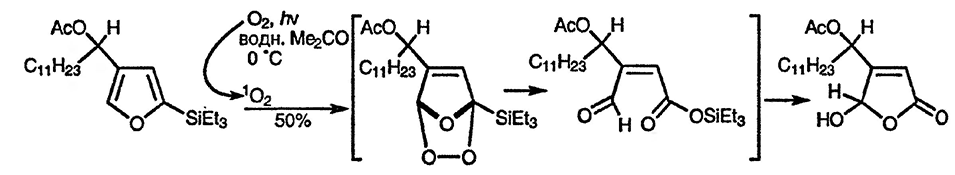
Фураны также вступают в реакции циклоприсоединения с синглетным кислородом [94]. Эта реакция лежит в основе некоторых синтезов высокоокисленных соединений, например 5-гидрокси-2(5Н)-фуранонов (4-гидроксибут-2-енолидов, см. разд. 15.12.), структурный фрагмент которых встречается в некоторых природных соединениях.
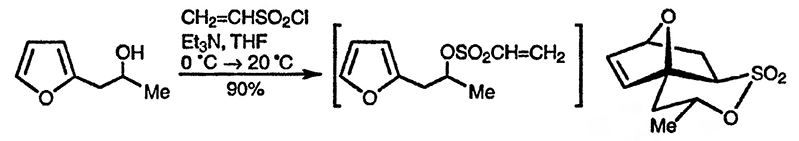
Присоединение к 3-замещённым фуранам в присутствии пространственно затруднённых оснований [95] или к 2-триалкилсилил-4-замещенным фуранам [96] [97] напрямую приводит к 4-замещенным 5-гидрокси-2(5Н)-фуранам, как показано ниже. 5-Замещённые фураноны также дают 5-гидрокси-2(5Н)-фураноны с потерей альдегидного атома углерода [98]. Особенно изящным примером служит реакция 2-фуранкарбоновой кислоты, которая с количественным выходом при декарбоксилировании превращается в моноальдегид малеиновой кислоты (циклический полуацеталь Z-4-оксобут-2-еновой кислоты) [99].
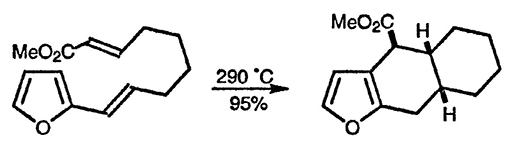
Известно несколько примеров, когда винилфураны принимают участие в реакциях внутримолекулярного циклоприсоединения в качестве 4π-компонентов [100], как показано ниже [101]. Вообще, для таких внутримолекулярных процессов характерны низкие выходы, поскольку межмолекулярные реакции конкурируют с более вероятными внутримолекулярными, а введение объёмного заместителя в α-положение молекулы способствует межмолекулярным процессам [102].
15.8. Электроциклические реакции (основного состояния)
Список литературы к главе 15
Упражнения к главе 15
Глава 15
- 15. Фураны: реакции и методы синтеза
- 15.1. Реакции с электрофильными реагентами
- 15.1.1. Протонирование
- 15.1.1.1. Реакции протонированных фуранов
- 15.1.2. Нитрование
- 15.1.3. Сульфирование
- 15.1.4. Галогенирование
- 15.1.5. Ацилирование
- 15.1.6. Алкилирование
- 15.1.7. Конденсация с альдегидами и кетонами
- 15.1.8. Конденсация с иминами и иминиевыми солями
- 15.1.9. Меркурирование
- 15.2. Реакции с окислителями
- 15.3. Реакции с нуклеофильными реагентами
- 15.4. Реакции с основаниями
- 15.4.1. Депротонирование C-водорода
- 15.5. Реакции C-металлированных фуранов
- 15.5.1. Литийорганические производные
- 15.5.2. Реакции сочетания, катализируемые палладием
- 15.6. Реакции со свободными радикалами
- 15.7. Реакции с восстановителями
- 15.8. Электроциклические реакции (основного состояния)
- 15.9. Фотохимические реакции
- 15.10. C-X-производные фурана; реакции с участием заместителей
- 15.11. Фуранкарбоновые кислоты и их эфиры
- 15.12. Окси- и аминофураны
- 15.12.1. Оксифураны
- 15.12.2. Аминофураны
- 15.13. Синтезы фуранов
- 15.13.1. Синтез кольца
- 15.13.1.1. Из 1,4-дикарбонильных соединений
- 15.13.1.2. Из γ-гидрокси-α,β-ненасыщенных карбонильных соединений
- 15.13.1.3. Из алленилкетонов
- 15.13.1.4. Из α-галогенокарбонильных и 1,3-дикарбонильных соединений
- 15.13.1.5. Другие методы
- 15.13.2. Примеры синтезов некоторых важных производных фурана
- 15.13.2.1. Трис(фуранил)-18-краун-6
- 15.13.2.2. Фуранеол
- 15.13.2.3. Ранитидин
Дополнительно:
 Комплексная переработка многокомпонентных жидких систем
Комплексная переработка многокомпонентных жидких систем Рассмотрена комплексная переработка многокомпонентных жидких систем в ...
В сборник включены наиболее интересные статьи по теории и практике переработки ...
 Вода обыкновенная и необыкновенная
Вода обыкновенная и необыкновенная В книге рассмотрен широкий круг вопросов, связанных со свойствами воды. Создана и ...
 Химия и технология полимерных плёнок
Химия и технология полимерных плёнок Книга посвящена химии и технологии производства плёночных материалов из ...