14.1.1.4. Галогенирование
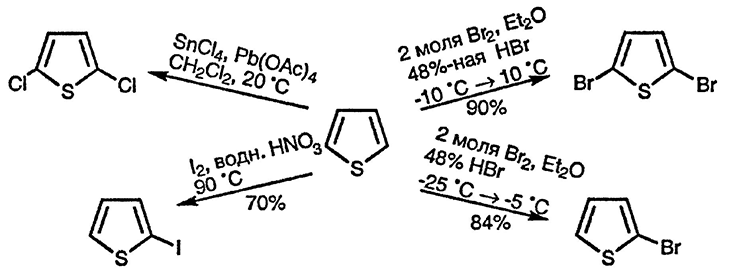
Галогенирование тиофена происходит очень быстро и как при комнатной температуре, так и при —30 °C в темноте легко проходит тетразамещение [19]. Скорость галогенирования тиофена при 25 °C примерно в 108 раз больше, чем бензола [20]. Образование как 2,5-дибром- и 2,5-дихлортиофенов [21], так и 2-бром- [22] и 2-иодтиофенов [23] гладко происходит в различных контролируемых условиях. Контролируемое бромирование 3-бромтиофена даёт 2,3-ди-бромтиофен [24].
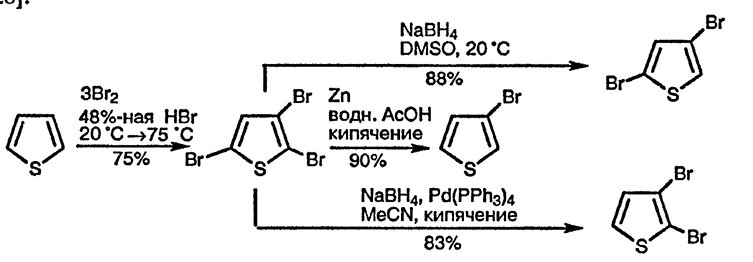
2,3,5-Трибромирование тиофена гладко протекает в 48 %-ном растворе HBr [25]. Давно известно, что при обработке полигалогенотиофенов цинком и кислотой удаётся селективно удалять α-галоген, что делает доступным получение 3-бромтиофена [26], а 3,4-дибромтиофен аналогично образуется при восстановлении тетрабромида [27]. Для объяснения этого процесса можно предложить следующую схему: первоначально происходит перенос электрона на атом брома, затем селективное удаление галогена таким образом, чтобы «переходный анион» был наиболее устойчивым — обычно из α-положения (разд. 14.4.1.). При использовании боргидрида натрия из 2,3,5-трибромтиофена получают 2,3-дибромтиофен [в присутствии катализатора Pd(0)] или 2,4-дибромтиофен (без катализатора) [28].
Моноиодирование α-замещенныхтиофенов, независимо оттого, оказывают ли эти заместители активирующее или дезактивирующее влияние, идёт по второму α-положению при действии йода и иодбензолдиацетата [29]. 3-Алкилтиофены можно монобромировать или моноиодировать по положению 2 при использовании N-бромсукцинимида [30] или йода в присутствии оксида ртути(II) [31] соответственно.
Глава 14
- 14. Тиофены: реакции и методы синтеза
- 14.1. Реакции с электрофильными реагентами
- 14.1.1. Реакции замещения по атому углерода
- 14.1.1.1. Протонирование
- 14.1.1.2. Нитрование
- 14.1.1.3. Сульфирование
- 14.1.1.4. Галогенирование
- 14.1.1.5. Ацилирование
- 14.1.1.6. Алкилирование
- 14.1.1.7. Конденсация с альдегидами и кетонами
- 14.1.1.8. Конденсация с иминами и иминиевыми ионами
- 14.1.1.9. Меркурирование
- 14.1.2. Присоединение по атому серы
- 14.2. Реакции с окислителями
- 14.3. Реакции с нуклеофильными реагентами
- 14.4. Реакции с основаниями
- 14.4.1. Депротонирование C-водорода
- 14.5. Реакции C-металлированных тиофенов
- 14.5.1. Литий- и магнийорганические производные
- 14.5.2. Реакции, катализируемые палладием, никелем или медью
- 14.6. Реакции со свободными радикалами
- 14.7. Реакции с восстановителями
- 14.8. Электроциклические реакции (основного состояния)
- 14.9. Фотохимические реакции
- 14.10. Х-Метиллпроизводные тиофена: тенилпроизводные
- 14.11. Тиофенальдегиды, тиофенкетоны, тиофенкарбоноые кислоты и их эфиры
- 14.12. Гидрокси- и аминотиофены
- 14.12.1. Гидрокситиофены
- 14.12.2. Аминотиофены
- 14.13. Синтезы тиофенов
- 14.13.1. Синтез кольца
- 14.13.1.1. Из 1,4-дикарбонильных соединений и источника серы
- 14.13.1.2. Из тиодиацетатов и 1,2-дикарбонильных соединений
- 14.13.1.3. Из тиогликолятов и 1,3-дикарбонильных соединений
- 14.13.1.4. Из α-тиокарбонильных соединений
- 14.13.1.5. Из тиодикетонов
- 14.13.1.6. С использованием сероуглерода
- 14.13.1.7. Из тиазолов
- 14.13.1.8. Из тионитроацетамидов
- 14.13.2. Примеры некоторых важных синтезов производных тиофена
- 14.13.2.1. Тиено[3,4-b]тиофен
- 14.13.2.2. 2,2’:5’,3’’-Tритиофен
- 14.13.2.3. [6.6]Парациклофан
Дополнительно:
Рассмотрено применение различных химических, физико-химических и физических ...
 Поливинилхлорид в промышленности
Поливинилхлорид в промышленности Книга инженеров X. Юнгникеля и X. Виппенхона «Поливинилхлорид в промышленности» ...
 Справочник по общей и неорганической химии
Справочник по общей и неорганической химии В справочнике рассмотрен материал по общей и неорганической химии. В 6 разделах ...
Книга представляет собой краткое руководство по технологии переработки ...