5.14.2. Нуклеофильное присоединение и замещение
Скорость нуклеофильного замещения атома галогена в α- и γ-положениях N-оксида пиридина выше, чем в самом пиридине. Порядок реакционной способности заместителей (4 > 2 > 3) в реакциях нуклеофильного замещения одинаков и для пиридина, и для N-оксида пиридина; другой порядок реакционной способности обнаружен для иодидов N-метилпиридиния (2 > 4 > 3) [238].
Реактивы Гриньяра присоединяются к N-оксидам пиридина с образованием аддуктов, которые могут быть охарактеризованы при низких температурах. При комнатной температуре эти аддукты претерпевают диеротаторное раскрытие цикла, в результате которого образуются ациклические ненасыщенные оксимы. Нагревание этих оксимов в уксусном ангидриде приводит к образованию ароматических структур в результате электроциклического замыкания цикла и необратимого элиминирования молекулы уксусной кислоты [239].
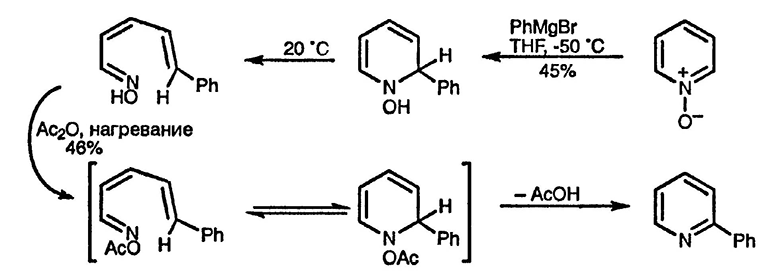
Аналогичное раскрытие никла в результате нуклеофильного присоединения наблюдается и для 1-алкоксипиридиниевых катионов [240] [241], однако предварительное ацилирование N-оксидов пиридина и дальнейшее взаимодействие с алкильными и арильными реактивами Гриньяра сразу приводит к образованию 2-замешенных производных пиридина [241] [242]
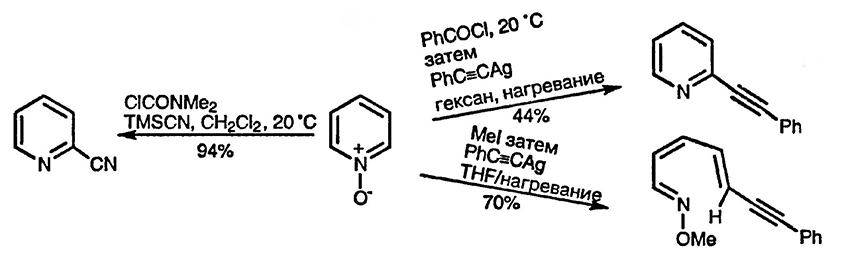
Очень удобный способ превращения N-оксида пиридина в 2-цианопиридин основан на предварительном превращении N-оксида в силилокси- или карбаматное производное [243]. Этот метод полностью вытеснил ранее используемый способ получения 2-цианопиридина из N-алкоксипиридиниевых солей [244].
Глава 5
- 5. Пиридины: реакции и методы синтеза
- 5.1. Реакции с электрофильными реагентами
- 5.1.1. Присоединение к атому азота
- 5.1.1.1. Протонирование атома азота
- 5.1.1.2. Нитрование по атому азота
- 5.1.1.3. Аминирование по атому азота
- 5.1.1.4. Окисление атома азота
- 5.1.1.5. Сульфирование по атому азота
- 5.1.1.6. Галогенирование по атому азота
- 5.1.1.7. Ацилирование по атому азота
- 5.1.1.8. Алкилирование по атому азота
- 5.1.1.9. Реакции комплексообразования
- 5.1.2. Реакции замещения при атоме углерода
- 5.1.2.1. Протонный обмен
- 5.1.2.2. Нитрование
- 5.1.2.3. Сульфирование
- 5.1.2.4. Галогенирование
- 5.1.2.5. Ацетоксимеркурирование
- 5.1.2.6. Реакции замещения в пиридинах, содержащих активированный атом азота и кислородсодержащие заместители
- 5.2. Реакции с окислителями
- 5.3. Реакции с нуклеофильными реагентами
- 5.3.1. Нуклеофильное замещение атома водорода
- 5.3.1.1. Алкилирование и арилирование
- 5.3.1.2. Аминирование
- 5.3.1.3. Гидроксилирование
- 5.3.2. Нуклеофильное замещение хорошо уходящих групп
- 5.4. Реакции с основаниями
- 5.4.1. Депротонирование при атоме углерода
- 5.5. Реакции c-металлированных пиридинов
- 5.5.1. Литий- и магнийорганические производные
- 5.5.2. Реакции, катализируемые палладием
- 5.6. Реакции со свободными радикалами, реакции пиридил-радикалов
- 5.6.1. Галогенирование
- 5.6.2. Реакции с углеродными радикалами
- 5.6.3. Димеризация
- 5.6.4. Пиридил-радикалы
- 5.7. Реакции с восстановителями
- 5.8. Электроциклические реакции (основного состояния)
- 5.9. Фотохимические реакции
- 5.10. Окси- и аминопиридины
- 5.10.2. Реакции пиридонов
- 5.10.2.1. Электрофильное присоединение и замещение
- 5.10.2.2. Депротонирование и реакции солей
- 5.10.2.3. Замещение атома кислорода
- 5.10.2.4. Тио-2-пиридоны
- 5.10.3. Реакции аминопиридинов
- 5.10.3.1. Электрофильное присоединение и замещение
- 5.10.3.2. Реакции аминогруппы
- 5.11. Алкилпиридины
- 5.12. Пиридиновые альдегиды, кетоны, карбоновые кислоты и их эфиры
- 5.13. Четвертичные пиридиниевые соли
- 5.13.1. Восстановление и окисление
- 5.13.2. Присоединение металлоорганических реагентов
- 5.13.3. Другие реакции нуклеофильного присоединения
- 5.13.4. Нуклеофильное присоединение с последующим раскрытием цикла
- 5.13.5. Реакции циклизации с участием α-положений или α-заместителей
- 5.13.6. N-Дезалкилирование
- 5.14. N-оксиды пиридина
- 5.14.1. Электрофильное присоединение и замещение
- 5.14.2. Нуклеофильное присоединение и замещение
- 5.14.3. Перегруппировки
- 5.15. Синтез пиридинов
- 5.15.1. Синтез кольца
- 5.15.1.1. Из аммиака и 1,5-дикарбонильных соединений
- 5.15.1.2. Из альдегида, двух молекул 1,3-дикарбонильного соединения и аммиака
- 5.15.1.2.1. Синтез Ганча
- 5.15.1.3. Из 1,3-Дикарбонильных соединений и 3-аминоенонов или 3-аминонитрилов
- 5.15.1.3.1. Синтез Гуарески
- 5.15.1.4. С использованием реакций циклоприсоединения
- 5.15.1.5. С использованием термической электроциклизации
- 5.15.1.6. Из фуранов
- 5.15.1.7. Прочие методы
- 5.15.2. Примеры синтезов некоторых важных производных пиридина
- 5.15.2.1. Фузариновая кислота
- 5.15.2.2. Пиридоксин
- 5.15.2.3. 2-Метокси-4-метил-5-нитропиридин
- 5.15.2.4. Немертеллин
Дополнительно:
В издании автор рассматривает важные теоретические вопросы по химической ...
 Вода обыкновенная и необыкновенная
Вода обыкновенная и необыкновенная В книге рассмотрен широкий круг вопросов, связанных со свойствами воды. Создана и ...
 Применение полимерных материалов в качестве покрытий
Применение полимерных материалов в качестве покрытий Широкое развитие производства полимерных материалов, постоянное улучшение их ...
Описаны синтез, свойства и строение комплексонов и комплексонатов металлов, ...