13.18.1.2. Из α-аминокарбонильных соединений и активированных кетонов
α-Аминокетоны взаимодействуют с карбонильными соединениями, обладающими α-метиленовой группой, преимущественно активированной дополнительным акцепторным заместителем, как, например, в эфирах β-кетокислот
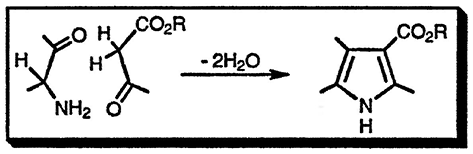
Синтез Кнорра
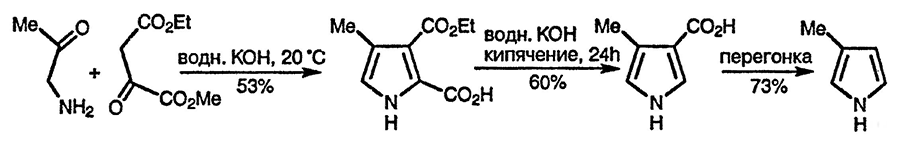
Широко используемый общий подход к синтезу производных пиррола связан с использованием двух компонентов: один — α-аминокарбонильное соединение, которое поставляет в будущий пиррольный цикл атом азота и атомы углерода C(2) и C(3), и второй компонент, поставляющий атомы C(4) и C(5), в котором должна быть метальная группа в α-положении к карбонильной. Синтез Кнорра эффективен только в том случае, если метиленовая группа дополнительно активирована (например, как в ацетоуксусном эфире); при этом конденсация, приводящая к пирролу, успешно конкурирует с самоконденсацией α-аминокарбонильных соединений. Ниже в качестве иллюстрации приведён синтез 4-метилпиррол-3-карбоновой кислоты и её последующее превращение в 3-метилпиррол:
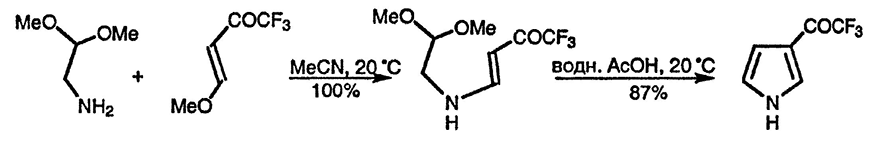
Поскольку α-аминокарбонильные соединения очень легко претерпевают самоконденсацию с образованием дигидропиразинов (разд. 11.13.), их обычно получают и используют в виде солей с высвобождением соответствующих свободных оснований под действием оснований, присутствующих в реакционной смеси. Альтернативно в синтезе Кнорра используются аминокарбонильные соединения с защищённой карбонильной группой, такие, как аминоацеталь [H2NCH2CH(OEt)2], вместе с эфирами енолов 1,3-дикетонов в качестве предшественников активированных карбонильных соединений [143]
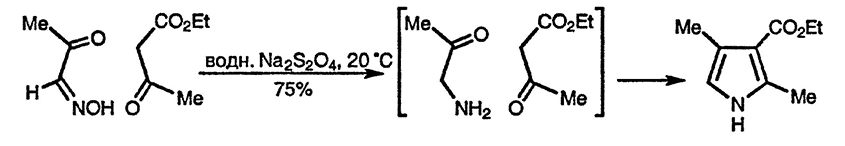
Избежать прямого использования α-аминокарбонильных соединений можно, получая их в присутствии второго компонента синтеза Кнорра. В качестве восстановителя для превращения оксиминной группы в аминную, применяют цинк в уксусной кислоте и дитионит натрия [144]; при этом кетонная и сложноэфирная группы остаются незатронутыми
В классическом варианте синтеза Кнорра в качестве α-аминокарбонильной компоненты используется аминопроизводное другой карбонильной компоненты, которое генерируется из оксиминопроизводного in situ [145]
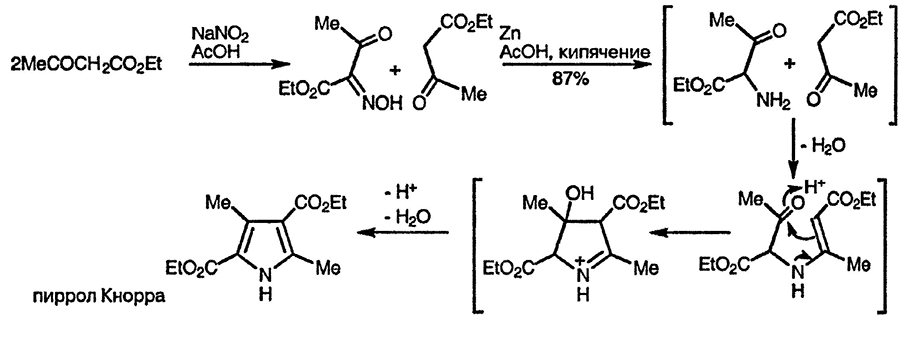
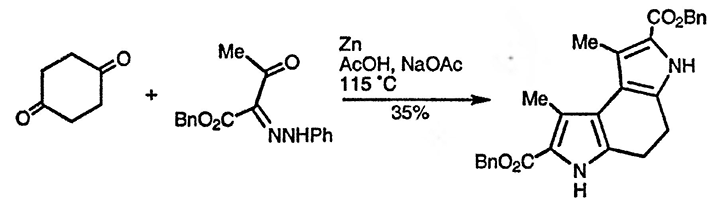
Согласно предполагаемому механизму процесса, показанному на примере образования пиррола Кнорра, на первой стадии происходит образование связи N — C(2), что предполагает присоединение атома азота к более электрофильной из двух карбонильных групп второй компоненты. Аналогично образование связи C(3) — C(4) происходит с участием более электрофильной (когда возможно альтернативное течение реакции) карбонильной группы α-аминокарбонильной компоненты. Существует множество элегантных примеров применения этого подхода к синтезу производных пиррола. Интересен пример образования двух пиррольных циклов при использовании в качестве предшественника α-амино-карбонильного соединения фенилгидразона, как показано ниже [146]:
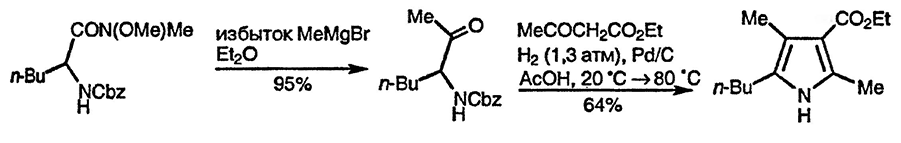
Современные подходы к α-аминокарбонильным соединениям основаны на реакции 2-бромкетонов с диформамидом натрия с образованием α-формамидо-кетонов [147] и на взаимодействии амидов Вайнреба N-защищённых α-аминокислот с реактивами Гриньяра с последующим удалением N-защитной группы в присутствии второго компонента, как показано ниже [148]. Гидридное восстановление амидов Вайнреба N-защищённых α-аминокислот приводит к образованию α-аминоальдегидов, также используемых в этом подходе к синтезу производных пиррола [149].
Бис(метилтио)нитроэтилен при взаимодействии с органическими купратами замещает одну метилтиогруппу на алкильную или арильную. Далее продукт этой реакции при взаимодействии с аминоацеталями, (в качестве предшественников α-аминокарбонильных соединений) превращается в ациклическое соединение, замыкание цикла в котором приводит к 2-замещённым 3-нитро-пирролам [150].
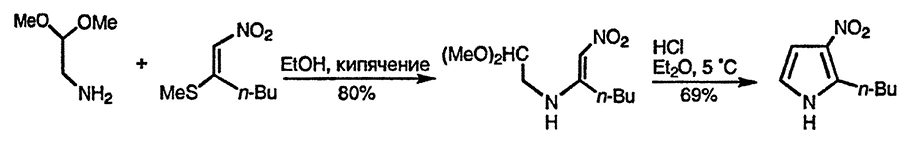
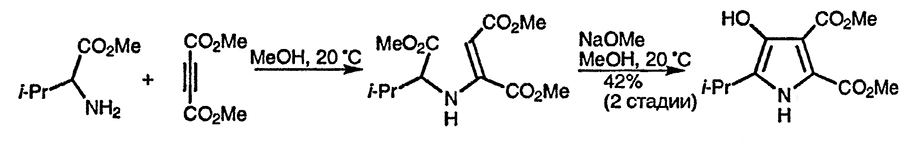
Енамины, образующиеся при присоединении эфиров α-аминокислот к диметиловому эфиру ацетилен-дикарбоновой кислоты, способны превращаться в 3-гидроксипирролы в результате замыкания цикла по типу конденсации Кляйзена [151].
13.18.1.2. Из α-аминокарбонильных соединений и активированных кетонов
Список литературы к главе 13
Упражнения к главе 13
Глава 13
- 13. Пирролы: реакции и методы синтеза
- 13.1. Реакции с электрофильными реагентами
- 13.1.1. Протонирование
- 13.1.1.1. Реакции протонированных пирролов
- 13.1.2. Нитрование
- 13.1.3. Сульфирование и реакции с использованием других серосодержащих электрофильных реагентов
- 13.1.4. Галогенирование
- 13.1.5. Ацилирование
- 13.1.6. Алкилирование
- 13.1.7. Конденсация с альдегидами и кетонами
- 13.1.8. Конденсации с иминами и иминиевыми ионами
- 13.1.9. Сочетание с солями диазония
- 13.2. Реакции с окислителями
- 13.3. Реакции с нуклеофильными реагентами
- 13.4. Реакции с основаниями
- 13.4.1. Депротонирование атома азота
- 13.4.2. Депротонирование по атому углерода
- 13.5. Реакции N-металлированных производных пиррола
- 13.5.1. Литий-, натрий-, калий-, магний- и цинкорганические производные
- 13.6. Реакции C-металлированных производных пиррола
- 13.6.1. Литийорганические производные
- 13.6.2. Реакции, катализируемые палладием
- 13.7. Реакции с радикальными реагентами
- 13.8. Реакции с восстановителями
- 13.9. Электроциклические реакции (основного состояния)
- 13.10. Реакции с карбенами и карбеноидами
- 13.11. Фотохимические реакции
- 13.12. Реакции пиррил-C-X-соединений
- 13.13. Пирролальдегиды и пирролкетоны
- 13.14. Пирролкарбоновые кислоты
- 13.15. Эфиры пирролкарбоновых кислот
- 13.16. Галогенопирролы
- 13.17. Окси- и аминопирролы
- 13.17.1. 2-Оксипирролы
- 13.17.2. 3-Оксипирролы
- 13.17.3. Аминопирролы
- 13.18. Методы синтеза пирролов
- 13.18.1. Синтез кольца
- 13.18.1.1. Из 1,4-дикарбонильных соединений и аммиака или первичных аминов
- 13.18.1.2. Из α-аминокарбонильных соединений и активированных кетонов
- 13.18.1.3. Из α-галогенокарбонильных соединений
- 13.18.1.4. Из тозилметилизоцианида и α,β-непредельных эфиров или кетонов и из изоцианоацетатов и α,β-непредельных нитросоединений
- 13.18.1.5. Из 1,3-дикарбонильных соединений и эфиров глицина
- 13.18.1.6. Из алкинов и оксидооксазолиевых солей
- 13.18.2.1. Некоторые современные общие подходы к синтезу пиррола
- 13.18.2.2. Из альдегидов, аминов и нитроалканов
- 13.18.2.3. Из 4-аминоацетиленов и из 4-аминоацетиленовых кетонов
- 13.18.2.4. Из 2-аминокетонов через промежуточное образование алкилиденкарбенов
- 13.18.3. Примеры синтезов некоторых важных производных пиррола
- 13.18.3.1. Порфобилиноген
- 13.18.3.2. Октаэтилпорфирин
- 13.18.3.3. Октаэтилпорфирин
- 13.18.3.4. Октаэтилгемипорфицен
- 13.18.3.5. Бензо[1,2-b:4,3-b’]дипиррол
- 13.18.3.6. Эпибатидин
Дополнительно:
 Применение полимерных материалов в конструкциях, работающих под нагрузкой
Применение полимерных материалов в конструкциях, работающих под нагрузкой Книга написана одним из старейших работников отечественной промышленности ...
Книга является учебным пособием для студентов по специальному курсу химии ...
 Энантиомерно чистые небелковые аминокислоты. Способы получения
Энантиомерно чистые небелковые аминокислоты. Способы получения Первая в отечественной литературе монография, посвящённая небелковым ...
 С. В. Лебедев. Жизнь и труды
С. В. Лебедев. Жизнь и труды Ленинград, 1938. ОНТИ ХИМТЕОРЕТ. Издательский переплёт. Сохранность хорошая. 2 мая 1934 ...