13.9. Электроциклические реакции (основного состояния)
Простые производные пиррола не вступают в реакции циклоприсоединения в качестве диенов; так, например, выдерживание пиррола с дегидробензолом приводит к лишь к образованию 2-фенилпиррола с низким выходом [93]. Однако при введении заместителей к атому азота пиррола, в особенности электроноакцепторных, склонность к таким реакциям повышается [94]: таким путём могут быть получены аддукты производных дегидробензола с 1-триметилсилил-пирролом [95].
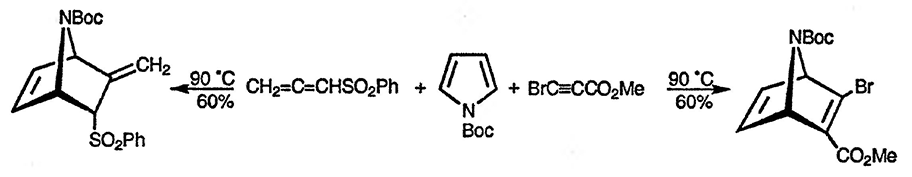
В то время как реакция незамещённого пиррола с диметиловым эфиром ацетилендикарбоновой кислоты приводит к образованию продукта замещения по положению 2 даже при повышенном давлении [96], 1-ацетил- и 1-алкоксикарбонилпирролы в этих условиях превращаются в соответствующие циклоаддукты [97]. Циклоприсоединение в значительной степени ускоряется при проведении реакции при высоком давлении или в присутствии катализатора — хлорида алюминия [98]. N-трет-Бутилоксикарбонилпиррол наиболее часто используется в качестве субстрата реакций циклоприсоединения; ниже приведён пример использования этого производного пиррола [99]:
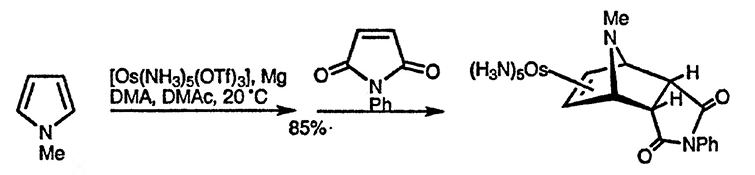
Другой приём, используемый для активации пирролов в реакциях циклоприсоединения, заключается в предварительном превращении их в осмиевые комплексы [100]. При такой активации возможны реакции даже с обычными электрофилами в мягких условиях; соответствующие аддукты образуются в результате последующего окислительного разрушения комплекса с осмием [101].
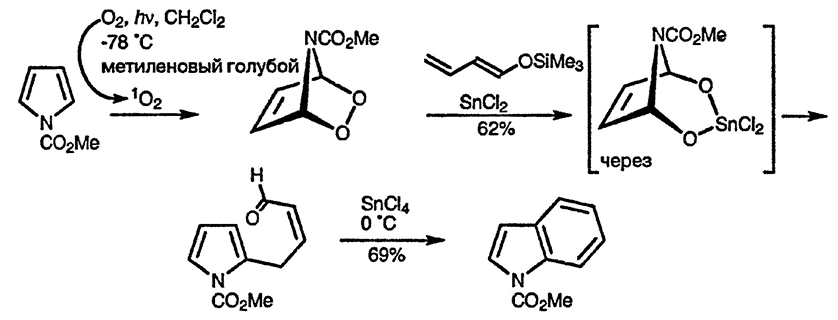
Процесс присоединения синглетного кислорода к 1-алкил- и, особенно, 1-ацилпирролам [102], приводящий к образованию 2,3-диокса-7-азаби-цикло[2.2.1]гептанов, имеет ценное синтетическое применение. Продукты присоединения вступают в реакцию с нуклеофильными реагентами, такими, как силиловые эфиры енолов, и при содействии хлорида олова(II) превращаются в 2-замещённые пирролы. Последние можно использовать, как показано на приведённой ниже схеме, в синтезе индолов:
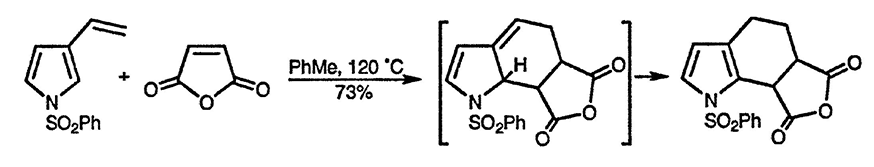
Винилпирролы, содержащие фенилсульфонильную группу при атоме азота, вступают в реакцию Дильса—Альдера в качестве диенов [103]. Первоначально образующиеся продукты циклоприсоединения легко изомеризуются, что приводит к ароматическому пиррольному производному [104].
Межмолекулярные реакции циклоприсоединения, в которых пиррол выступает в качестве 2π-электронной системы, крайне малочисленны, однако три-циклический 6-азаиндол может быть легко получен в результате внутримолекулярной реакции 4л-электронной системы 1,2,4-триазина с пирролом (разд. 25.2.1.) [105].
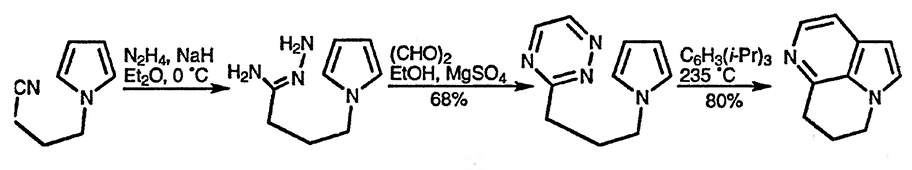
13.9. Электроциклические реакции (основного состояния)
Список литературы к главе 13
Упражнения к главе 13
Глава 13
- 13. Пирролы: реакции и методы синтеза
- 13.1. Реакции с электрофильными реагентами
- 13.1.1. Протонирование
- 13.1.1.1. Реакции протонированных пирролов
- 13.1.2. Нитрование
- 13.1.3. Сульфирование и реакции с использованием других серосодержащих электрофильных реагентов
- 13.1.4. Галогенирование
- 13.1.5. Ацилирование
- 13.1.6. Алкилирование
- 13.1.7. Конденсация с альдегидами и кетонами
- 13.1.8. Конденсации с иминами и иминиевыми ионами
- 13.1.9. Сочетание с солями диазония
- 13.2. Реакции с окислителями
- 13.3. Реакции с нуклеофильными реагентами
- 13.4. Реакции с основаниями
- 13.4.1. Депротонирование атома азота
- 13.4.2. Депротонирование по атому углерода
- 13.5. Реакции N-металлированных производных пиррола
- 13.5.1. Литий-, натрий-, калий-, магний- и цинкорганические производные
- 13.6. Реакции C-металлированных производных пиррола
- 13.6.1. Литийорганические производные
- 13.6.2. Реакции, катализируемые палладием
- 13.7. Реакции с радикальными реагентами
- 13.8. Реакции с восстановителями
- 13.9. Электроциклические реакции (основного состояния)
- 13.10. Реакции с карбенами и карбеноидами
- 13.11. Фотохимические реакции
- 13.12. Реакции пиррил-C-X-соединений
- 13.13. Пирролальдегиды и пирролкетоны
- 13.14. Пирролкарбоновые кислоты
- 13.15. Эфиры пирролкарбоновых кислот
- 13.16. Галогенопирролы
- 13.17. Окси- и аминопирролы
- 13.17.1. 2-Оксипирролы
- 13.17.2. 3-Оксипирролы
- 13.17.3. Аминопирролы
- 13.18. Методы синтеза пирролов
- 13.18.1. Синтез кольца
- 13.18.1.1. Из 1,4-дикарбонильных соединений и аммиака или первичных аминов
- 13.18.1.2. Из α-аминокарбонильных соединений и активированных кетонов
- 13.18.1.3. Из α-галогенокарбонильных соединений
- 13.18.1.4. Из тозилметилизоцианида и α,β-непредельных эфиров или кетонов и из изоцианоацетатов и α,β-непредельных нитросоединений
- 13.18.1.5. Из 1,3-дикарбонильных соединений и эфиров глицина
- 13.18.1.6. Из алкинов и оксидооксазолиевых солей
- 13.18.2.1. Некоторые современные общие подходы к синтезу пиррола
- 13.18.2.2. Из альдегидов, аминов и нитроалканов
- 13.18.2.3. Из 4-аминоацетиленов и из 4-аминоацетиленовых кетонов
- 13.18.2.4. Из 2-аминокетонов через промежуточное образование алкилиденкарбенов
- 13.18.3. Примеры синтезов некоторых важных производных пиррола
- 13.18.3.1. Порфобилиноген
- 13.18.3.2. Октаэтилпорфирин
- 13.18.3.3. Октаэтилпорфирин
- 13.18.3.4. Октаэтилгемипорфицен
- 13.18.3.5. Бензо[1,2-b:4,3-b’]дипиррол
- 13.18.3.6. Эпибатидин
Дополнительно:
Книга представляет собой монографию коллектива авторов. Отдельные статьи ...
 Теория углового момента
Теория углового момента Книга учёного из США относится к новому направлению в химии — динамической ...
 Введение в общую химию
Введение в общую химию Пособие рассматривает отдельные, наиболее сложные аспекты современной химии. ...