13.1.5. Ацилирование
Прямое ацетилирование пиррола уксусным ангидридом при 200 °C приводит к образованию 2-ацетилпиррола с примесью небольшого количества 3-ацетилпи-рола; N-ацетилпиррол в этих условиях вовсе не образуется [28]. N-Ацетилпиррол можно получить с высоким выходом при нагревании пиррола с N-ацетилимидазолом [29]. Алкильные заместители облегчают процесс ацилирования по атому углерода: так, 2,3,4-триметилпиррол превращается в 5-ацетилпроизвод-ное даже при кипячении в уксусной кислоте.
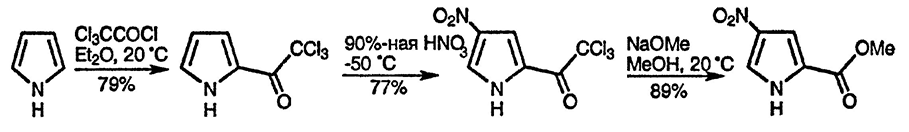
Более реакционноспособные трифторуксусный ангидрид и трихлорацетилхлорид реагируют с пирролом даже при комнатной температуре с образованием продуктов 2-ацилирования, которые в результате гидролиза или алкоголиза обеспечивают удобный синтетический подход к пиррол-2-карбоновым кислотам или их эфирам [30]. Сильные электроноакцепторные заместители (мета-ориентирующие группы) в α-положении пиррольного кольца склонны, изменять присущую пирролу региоселективность в реакциях электрофильного замещения — последующее замещение протекает по положению 4, а не по свободному α-положению [31].
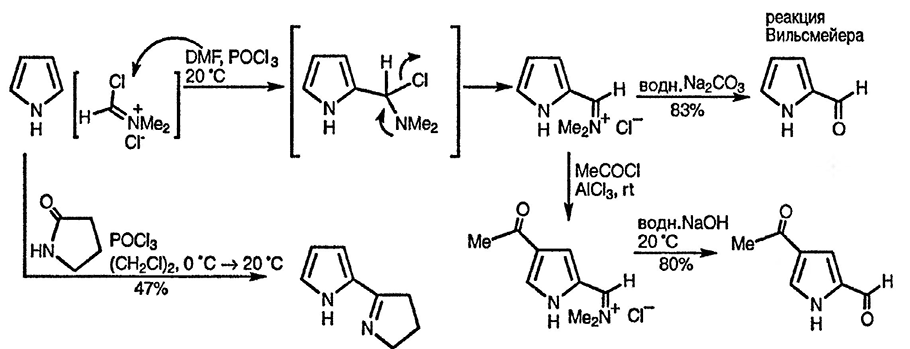
Ацилирование пиррола в условиях реакции Вильсмейера [32] [33] и особенно формилирование с использованием диметилформамида и фосфорилхлорида, нашли широкое применение [34]. Как показано ниже, фактически действующей электрофильной частицей в этом процессе служит N,N-диалкилхлорметилениминиевый катион [35].
В этом случае при наличии у атома азота пиррола объемного заместителя также наблюдается обращение свойственной пирролу реги-оселективности: так, формилирование N-тритилпиррола приводит к смеси α- и β-формилпроизводных в соотношении 1:2,8, в то время как при трифторацети-лировании такого производного пиррола образуется исключительно β-изомер [36]. Использование объёмной N-силильной группы и последующее её удаление позволяют получать 3-ацилпирролы [37].
Электрофильная частица, образующаяся при взаимодействии диметилформамида с фосфорилхлоридом, достаточно объёмна, что способствует увеличению доли продукта формилирования по β-положению в случае N-замещённых пирролов [38]. Иминиевая соль, промежуточно образующаяся при формилированиии в условиях реакции Вильсмейера, перед гидролизом может быть использована в последующей реакции электрофильного замещения в условиях реакции Фриделя—Крафтса. Поскольку иминиевый заместитель обладает сильным мета-ориентирующим действием, вторичное электрофильное замещение протекает по положению 4, что приводит в конечном итоге к 2,4-диацилированным пирролам [39]. При использовании в реакции Вильсмейера циклических амидов гидролиз не происходит и образуются циклические имины [40].
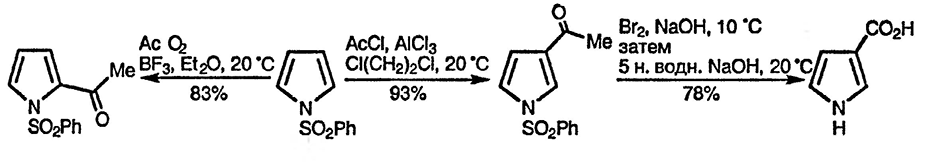
Ацилирование 1-фенилсульфонилпиррола вследствие наличия электроноакцепторного заместителя при атоме азота требует более жёстких условий — обычно использования кислоты Льюиса в качестве катализатора; региоселективность атаки электрофила зависит от катализатора и, особенно, от ацилирующего агента [41]. При катализе более слабыми кислотами Льюиса наблюдается увеличение доли продукта α-замещения. Зависимость региоселективности реакции ацилирования в условиях Фриделя—Крафтса от силы используемой кислоты Льюиса наблюдается также в случае производных пиррола, содержащих электроноакцепторные (стабилизирующие) группы при атоме углерода, как, например, в случае эфиров пирролкарбоновых кислот [42].
Ацилирование 3-ацилпирролов, легко получаемых в результате гидролиза 1-фенил-сульфонил-3-ацилпиролов, приводит к образованию 2,4-диацилированных пирролов [43], а формилирование метилового эфира пиррол-2-карбоновой кислоты — к 5-формильному производному [44]. Для получения пиррол-3-карбоновой кислоты можно эффективно использовать два метода: первый заключается в окислении 3-ацетил-1-фенилсульфонилпиррола [45], а второй — в гидролизе 1-тритил-3-трифторацетилпиррола и последующем удалении тритильной группы.
Глава 13
- 13. Пирролы: реакции и методы синтеза
- 13.1. Реакции с электрофильными реагентами
- 13.1.1. Протонирование
- 13.1.1.1. Реакции протонированных пирролов
- 13.1.2. Нитрование
- 13.1.3. Сульфирование и реакции с использованием других серосодержащих электрофильных реагентов
- 13.1.4. Галогенирование
- 13.1.5. Ацилирование
- 13.1.6. Алкилирование
- 13.1.7. Конденсация с альдегидами и кетонами
- 13.1.8. Конденсации с иминами и иминиевыми ионами
- 13.1.9. Сочетание с солями диазония
- 13.2. Реакции с окислителями
- 13.3. Реакции с нуклеофильными реагентами
- 13.4. Реакции с основаниями
- 13.4.1. Депротонирование атома азота
- 13.4.2. Депротонирование по атому углерода
- 13.5. Реакции N-металлированных производных пиррола
- 13.5.1. Литий-, натрий-, калий-, магний- и цинкорганические производные
- 13.6. Реакции C-металлированных производных пиррола
- 13.6.1. Литийорганические производные
- 13.6.2. Реакции, катализируемые палладием
- 13.7. Реакции с радикальными реагентами
- 13.8. Реакции с восстановителями
- 13.9. Электроциклические реакции (основного состояния)
- 13.10. Реакции с карбенами и карбеноидами
- 13.11. Фотохимические реакции
- 13.12. Реакции пиррил-C-X-соединений
- 13.13. Пирролальдегиды и пирролкетоны
- 13.14. Пирролкарбоновые кислоты
- 13.15. Эфиры пирролкарбоновых кислот
- 13.16. Галогенопирролы
- 13.17. Окси- и аминопирролы
- 13.17.1. 2-Оксипирролы
- 13.17.2. 3-Оксипирролы
- 13.17.3. Аминопирролы
- 13.18. Методы синтеза пирролов
- 13.18.1. Синтез кольца
- 13.18.1.1. Из 1,4-дикарбонильных соединений и аммиака или первичных аминов
- 13.18.1.2. Из α-аминокарбонильных соединений и активированных кетонов
- 13.18.1.3. Из α-галогенокарбонильных соединений
- 13.18.1.4. Из тозилметилизоцианида и α,β-непредельных эфиров или кетонов и из изоцианоацетатов и α,β-непредельных нитросоединений
- 13.18.1.5. Из 1,3-дикарбонильных соединений и эфиров глицина
- 13.18.1.6. Из алкинов и оксидооксазолиевых солей
- 13.18.2.1. Некоторые современные общие подходы к синтезу пиррола
- 13.18.2.2. Из альдегидов, аминов и нитроалканов
- 13.18.2.3. Из 4-аминоацетиленов и из 4-аминоацетиленовых кетонов
- 13.18.2.4. Из 2-аминокетонов через промежуточное образование алкилиденкарбенов
- 13.18.3. Примеры синтезов некоторых важных производных пиррола
- 13.18.3.1. Порфобилиноген
- 13.18.3.2. Октаэтилпорфирин
- 13.18.3.3. Октаэтилпорфирин
- 13.18.3.4. Октаэтилгемипорфицен
- 13.18.3.5. Бензо[1,2-b:4,3-b’]дипиррол
- 13.18.3.6. Эпибатидин
Дополнительно:
 Углеродные и другие жаростойкие волокнистые материалы
Углеродные и другие жаростойкие волокнистые материалы Углеродные и другие жаростойкие волокна обладают поистине уникальными ...
 Исследования по вопросу о трехатомном углероде и о строении простейших окрашенных производных трифенилметана
Исследования по вопросу о трехатомном углероде и о строении простейших окрашенных производных трифенилметана Воспроизведено в оригинальной авторской орфографии издания 1912 года ...
