11.1.1.2. Алкилирование
Диазины реагируют с алкилгалогенидами труднее, чем пиридин, с образованием четвертичных моносолей. Диалкилирование не удаётся осуществить при использовании алкилгалогенидов, однако с гораздо более реакционноспособными тетрафторборатами триалкилоксония могут быть получены дисоли для всех трёх диазинов [8].
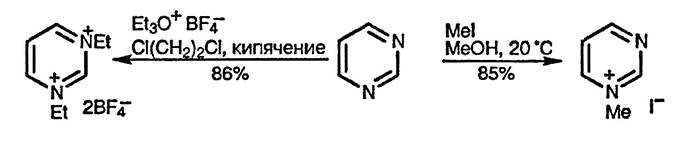
Пиридазин наиболее активен в реакциях алкилирования, что также связано с взаимным отталкиванием двух неподелённых пар электронов связанных атомов азота. Такое явление известно как «α-эффект» и проявляется также, например, в большей нуклеофильности пероксида водорода по сравнению с водой.
Несимметрично замещённые диазины при алкилировании способны образовывать две изомерные четвертичные соли. На направление алкилирования в гораздо большей степени влияют стерические и индуктивные, нежели мезомерные эффекты заместителей. Например, 3-метилпиридазин алкилируется преимущественно по атому N(1), хотя на атоме N(2) сосредоточена большая электронная плотность. Аналогично алкилирование 3-метоки-6-метилпиридазина проходит по атому азота, соседнему с метальной группой, хотя, учитывая мезомерное влияние метоксгруппы, следовало бы ожидать алкилирования другого атома азота [9].
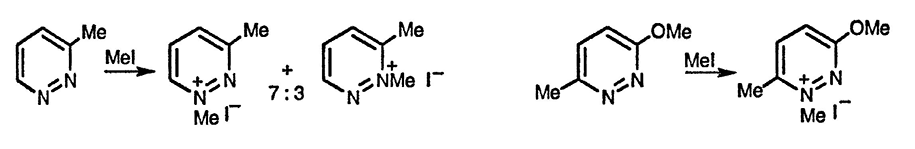
Глава 11
- 11. Диазины, пиридазины, пиримидины и пиразины: реакции и методы синтеза
- 11.1. Реакции с электрофильными реагентами
- 11.1.1. Присоединение по атому азота
- 11.1.1.1. Протонирование
- 11.1.1.2. Алкилирование
- 11.1.1.3. Окисление
- 11.1.2. Замещение при атоме углерода
- 11.1.2.1. Галогенирование
- 11.2. Реакции с окислителями
- 11.3. Реакции с нуклеофильными реагентами
- 11.3.1. Замещение атома водорода
- 11.3.1.1. Алкилирование и арилирование
- 11.3.1.2. Аминирование
- 11.3.2. Замещение других уходящих групп
- 11.4. Реакции с основаниями
- 11.4.1. Депротонирование при атоме углерода
- 11.4.2. Металлирование
- 11.5. Реакции С-металлированных диазинов
- 11.5.1. Литийорганические производные
- 11.5.2. Реакции, катализируемые палладием
- 11.6. Реакции с восстановителями
- 11.7. Реакции со свободными радикалами
- 11.8. Электроциклические реакции
- 11.9. N-оксиды диазинов
- 11.10. Оксидиазины
- 11.10.1. Строение оксидиазинов
- 11.10.2. Реакции оксидиазинов
- 11.10.2.1. Реакции с электрофильными реагентами
- 11.10.2.2. Реакции с нуклеофильными реагентами
- 11.10.2.3. Реакции с основаниями
- 11.10.2.4. Замещение атома кислорода
- 11.10.2.5. Реакции, катализируемые переходными металлами
- 11.10.2.6. Электроциклические реакции
- 11.11. Аминодиазины
- 11.12. Алкилдиазины
- 11.13. Четвертичные азиниевые соли
- 11.14. Синтез диазинов
- 11.14.1.1. Из 1,4-дикарбонильных соединений и гидразина
- 11.14.1.2. Реакцией циклоприсоединения 1,2,4,5-тетразина к производным ацетилена
- 11.14.1.3. С использованием других реакций циклоприсоединения
- 11.14.1.3.1. С использованием галогеносодержащих гидразонов
- 11.14.1.3.2. С использованием S,S-диоксидов тиофена
- 11.14.1.3.3. С использованием галогенозамещённых циклопропенов
- 11.14.2. Синтез пиримидинового кольца
- 11.14.2.1. Из 1,3-дикарбонильных соединений и соединений, содержащих фрагмент N-C-N
- 11.14.2.2. Реакцией циклоприсоединения 1,3,5-диазинов к производными ацетилена
- 11.14.2.3. Из 3-этоксиакрилоилизоцианата и первичных аминов
- 11.14.3. Синтез пиразинового цикла
- 11.14.3.1. Самоконденсацией 2-аминокетонов
- 11.14.3.2. Из 1,2-дикарбонильных соединений и 1,2-диаминов
- 11.14.3.3. Синтез пиразинов через сульфиды
- 11.14.4. Примеры некоторых важных синтезов диазинов
- 11.14.4.1. 4-Амино-5-циано-2-метилпиримидин
- 11.14.4.2. 4,6-Диамино-5-тиоформамидо-2-метилпиримидин
- 11.14.4.3. Карбоциклический бромвинилдезоксиуридин
- 11.14.4.4. Коелентеразин
- 11.14.4.5. 2,5-Диметил-3-н-пропилпиразин
- 11.15. Птеридины
Дополнительно:
 Технология переработки кристаллических полиолефинов
Технология переработки кристаллических полиолефинов Монография обобщает сведения о технологии основных процессов переработки ...
 ЛЕННИИХИММАШ. Труды том 8. Вопросы прочности химической аппаратуры
ЛЕННИИХИММАШ. Труды том 8. Вопросы прочности химической аппаратуры В сборнике освещены результаты работ по исследованию прочности, герметичности и ...
 Константы неорганических веществ. Справочник
Константы неорганических веществ. Справочник Справочник включает сведения о более чем 3 600 неорганических веществ и 2 400 ...