11.10.2.3. Реакции с основаниями
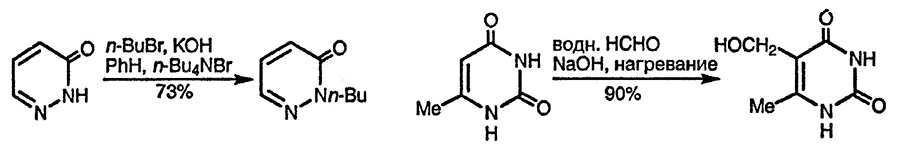
Подобно пиридонам, оксидиазины легко депротируруются в мягких условиях с образованием амбидентных анионов, которые можно проалкилировать в условиях межфазного катализа, главным образом по атому азота [98]. 3-Пиридазиноны в условиях межфазного катализа алкилируются исключительно по положению N(2) [99], в то время как региоселективность реакции алкилирования урацила трудно поддается контролю (см. ниже). Делокализация отрицательного заряда в N-анионе способствует в некоторых случаях C-алкилированию, как в случае реакции 6-метилурацила с формальдегидом [100] или солями диазония [101].
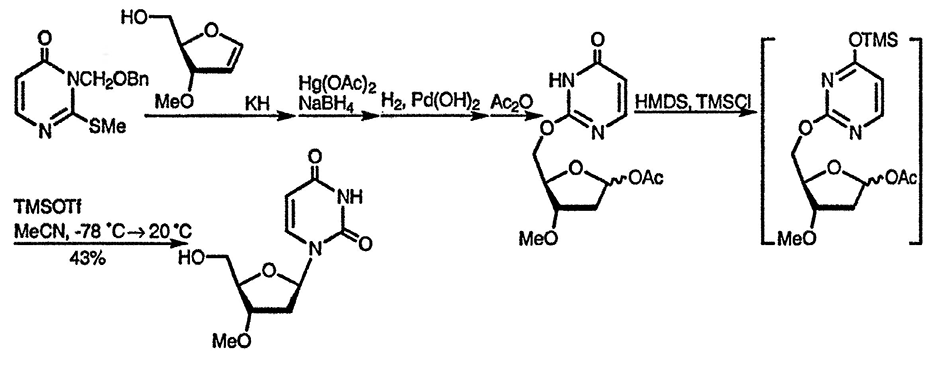
Алкилирование по атому кислорода также возможно, и этот процесс имеет важное значение в случае рибозидов, в которых он реализуется внутримолекулярно и способствует стереоконтролю реакций замещения в углеводном фрагменте, как в представленном ниже замещении 3’-гидроксильной группы на азидную с полным сохранением конфигурации [102].
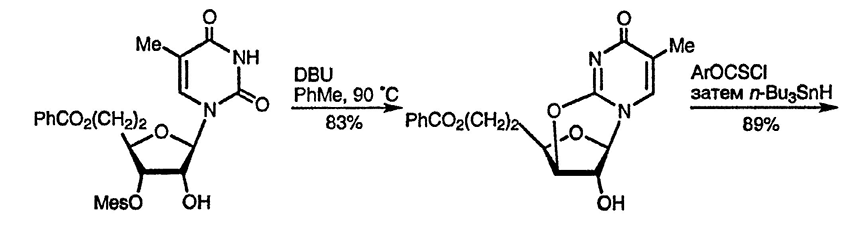
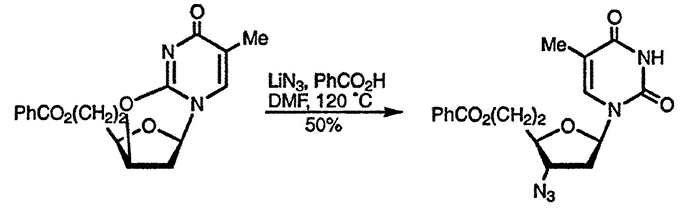
Известны также альтернативные методы N-алкилирования, включающие использование триметилфосфата [103], и алкилирование O-силилированных производных оксидиазинов. Последний метод важен для осуществления однозначного алкилирования по атому азота и особенно для введения рибозного остатка в молекулу урацила [105], поскольку обычно этот процесс вызывает некоторые стереохимические трудности, как и в случае пуринов (дальнейшее обсуждение см. разд. 24.2.1.2.).
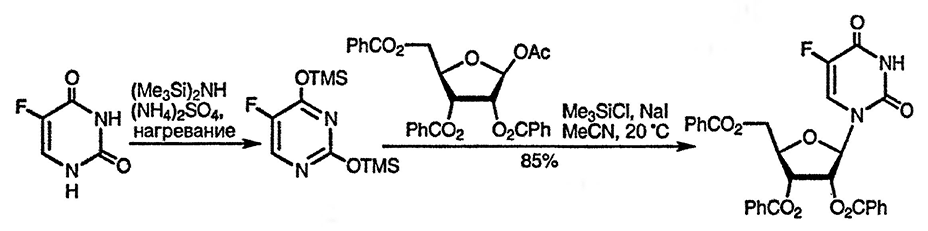
Стереоспецифическое введение остатка рибозы в молекулу урацила и других пиримидиновых оснований можно осуществить в результате первоначального введения заместителя к 5-гидроксиметильному фрагменту молекулы углевода и его последующего внутримолекулярного переноса к положению 2 [106].
С-Металлирование
С-Литиирование производных уридина изучено довольно тщательно с позиций возможности использования этого процесса для введения заместителей в положения 5 и 6. Группы, способные к хелатированию в положении 5′ (гидроксильная и метокиметоксильная), способствуют литиированию по положению 6 [107], поскольку, как показано, в условиях равновесия соответствующее литиевое производное наиболее стабильно. Кинетическое литиирование по атому углерода в положении 5 возможно в том случае, когда в качестве защитной группы в углеводном фрагменте используется силилоксигруппа, обладающая слабыми хелатирующими свойствами [108]. Примечательно, что в этом случае нет необходимости в защите NH-группы, что также иллюстрируется литиированием по положению 6 производного урацила, содержащего этоксиметильный заместитель при атоме N(1) [109].
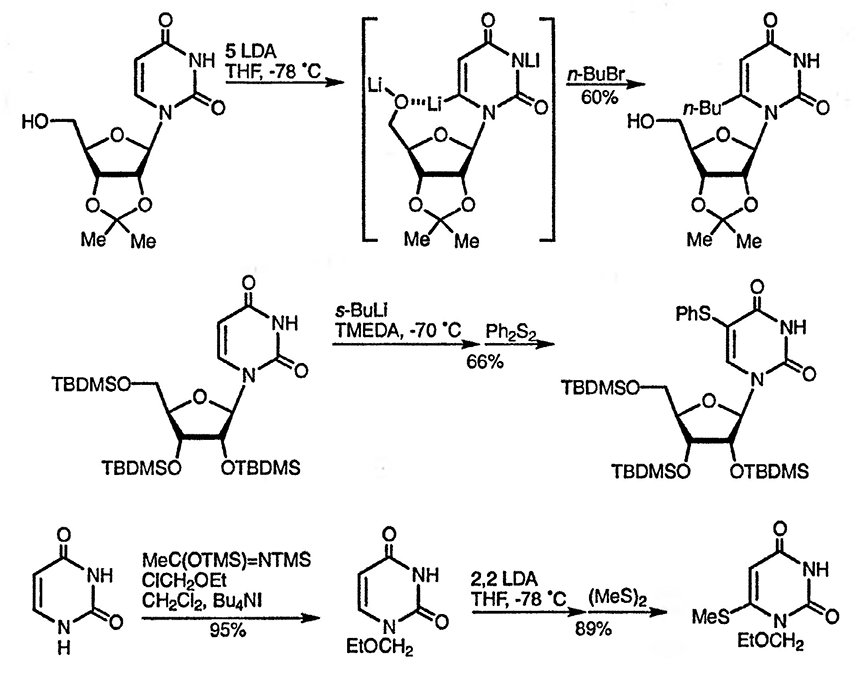
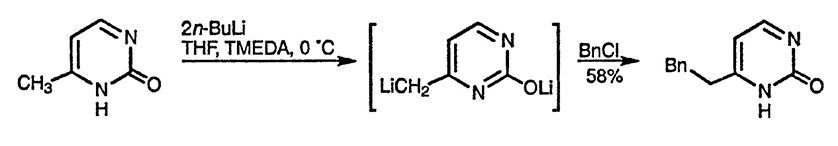
Защита группы NH также не обязательна при металлировании боковой цепи 6-метилпиримидиноНа-2 [110]
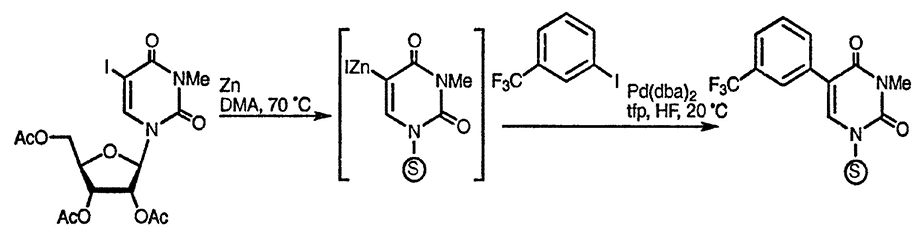
Цинкорганические производные урацила можно получить прямым взаимодействием соответствующего галогенопроизводного с цинковой пылью. Хотя цинкорганические производные урацила вступают в реакцию, с ограниченным числом электрофильных реагентов, они находят особое применение в реакциях сочетания, катализируемых палладием [111] (см. также разд. 11.10.2.5.)
Глава 11
- 11. Диазины, пиридазины, пиримидины и пиразины: реакции и методы синтеза
- 11.1. Реакции с электрофильными реагентами
- 11.1.1. Присоединение по атому азота
- 11.1.1.1. Протонирование
- 11.1.1.2. Алкилирование
- 11.1.1.3. Окисление
- 11.1.2. Замещение при атоме углерода
- 11.1.2.1. Галогенирование
- 11.2. Реакции с окислителями
- 11.3. Реакции с нуклеофильными реагентами
- 11.3.1. Замещение атома водорода
- 11.3.1.1. Алкилирование и арилирование
- 11.3.1.2. Аминирование
- 11.3.2. Замещение других уходящих групп
- 11.4. Реакции с основаниями
- 11.4.1. Депротонирование при атоме углерода
- 11.4.2. Металлирование
- 11.5. Реакции С-металлированных диазинов
- 11.5.1. Литийорганические производные
- 11.5.2. Реакции, катализируемые палладием
- 11.6. Реакции с восстановителями
- 11.7. Реакции со свободными радикалами
- 11.8. Электроциклические реакции
- 11.9. N-оксиды диазинов
- 11.10. Оксидиазины
- 11.10.1. Строение оксидиазинов
- 11.10.2. Реакции оксидиазинов
- 11.10.2.1. Реакции с электрофильными реагентами
- 11.10.2.2. Реакции с нуклеофильными реагентами
- 11.10.2.3. Реакции с основаниями
- 11.10.2.4. Замещение атома кислорода
- 11.10.2.5. Реакции, катализируемые переходными металлами
- 11.10.2.6. Электроциклические реакции
- 11.11. Аминодиазины
- 11.12. Алкилдиазины
- 11.13. Четвертичные азиниевые соли
- 11.14. Синтез диазинов
- 11.14.1.1. Из 1,4-дикарбонильных соединений и гидразина
- 11.14.1.2. Реакцией циклоприсоединения 1,2,4,5-тетразина к производным ацетилена
- 11.14.1.3. С использованием других реакций циклоприсоединения
- 11.14.1.3.1. С использованием галогеносодержащих гидразонов
- 11.14.1.3.2. С использованием S,S-диоксидов тиофена
- 11.14.1.3.3. С использованием галогенозамещённых циклопропенов
- 11.14.2. Синтез пиримидинового кольца
- 11.14.2.1. Из 1,3-дикарбонильных соединений и соединений, содержащих фрагмент N-C-N
- 11.14.2.2. Реакцией циклоприсоединения 1,3,5-диазинов к производными ацетилена
- 11.14.2.3. Из 3-этоксиакрилоилизоцианата и первичных аминов
- 11.14.3. Синтез пиразинового цикла
- 11.14.3.1. Самоконденсацией 2-аминокетонов
- 11.14.3.2. Из 1,2-дикарбонильных соединений и 1,2-диаминов
- 11.14.3.3. Синтез пиразинов через сульфиды
- 11.14.4. Примеры некоторых важных синтезов диазинов
- 11.14.4.1. 4-Амино-5-циано-2-метилпиримидин
- 11.14.4.2. 4,6-Диамино-5-тиоформамидо-2-метилпиримидин
- 11.14.4.3. Карбоциклический бромвинилдезоксиуридин
- 11.14.4.4. Коелентеразин
- 11.14.4.5. 2,5-Диметил-3-н-пропилпиразин
- 11.15. Птеридины
Дополнительно:
Предлагаемая книга «Всеобщей истории химии» посвящена развитию химии в XVII-XIX ...
 Курс лекций неорганической химии, читанных в Московской сельскохозяйственной ордена Ленина академии им. К. А. Тимирязева
Курс лекций неорганической химии, читанных в Московской сельскохозяйственной ордена Ленина академии им. К. А. Тимирязева Воспроизведено в оригинальной авторской орфографии издания 1940 года ...
 Основные законы химии (комплект из 2 книг)
Основные законы химии (комплект из 2 книг) Учебное пособие к изучению основных законов и представлений общей химии. Автор — ...
 Книга для чтения по неорганической химии (комплект из 2 книг)
Книга для чтения по неорганической химии (комплект из 2 книг) Перед вами третье издание «Книги для чтения по неорганической химии». Эта книга ...