11.11. Аминодиазины
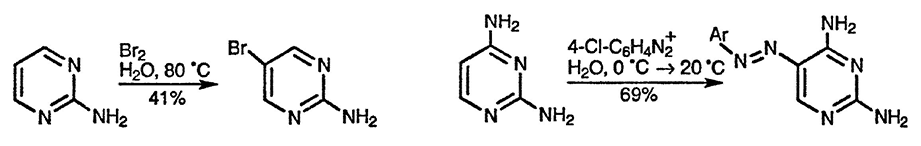
Для аминодиазинов характерно существование в аминоформе. Аминодиазины — более сильные основания, чем соответствующие незамещённые диазины и протонируются по одному из двух кольцевых атомов азота, что приводит к образованию двух изомерных катионов. Порядок предпочтительного протонирования кольцевых атомов азота следующий: γ > α > β по отношению к аминогруппе. Следовательно, аминодиазины, содержащие γ-аминогруппу, представляют собой наиболее сильные основания.
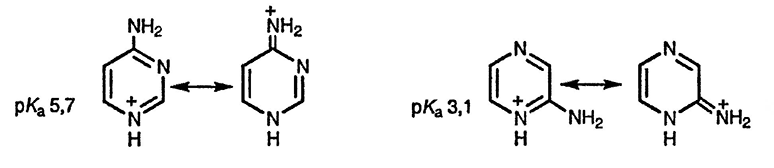
Перегруппировка четвертичных солей 2-аминопиримидина в присутствии щелочей представляют собой простейший вариант перегруппировки Димрота [135]. Чем больше заместитель при положительно заряженном атоме азота, тем выше скорость такой перегруппировки; несомненно, такая зависимость связана с напряжением, возникающим между заместителем и аминогруппой.
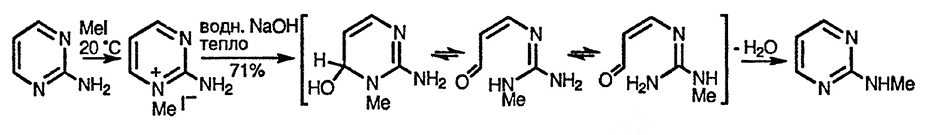
При взаимодействии с азотистой кислотой все аминодиазины [29] превращаются в соответствующие диазиноны через промежуточное образование крайне реакционноспособных диазониевых катионов. Даже в случае 5-аминопирими-дина не наблюдается образования стабильной соли диазония, хотя 2-хлорпири-мшшн может быть получен с низким выходом при диазотировании 2-аминопиримидина в концентрированной соляной кислоте [136].
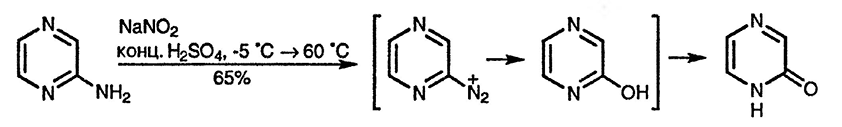
Введения одной аминогруппы в диазиновый цикл во многих случаях достаточно для облегчения реакций электрофильного замещения, например, галогенирования [137]; две аминогруппы активируют диазиновый цикл настолько, что становятся возможными реакции даже со слабыми электрофилами, такими, как дитиодициан (тиоцианоген)[138]. Диаминопиримидины вступают в реакции сочетания с солями диазония [139], что используется для введения третьей аминогруппы.
Для аминооксипиримидинов [140] и аминодиоксипиримидинов [141] характерны реакции C-нитрозирования; образующиеся при последующем восстановлении 5,6-диаминопиримидины используются в синтезе пуринов (см. приведённый ниже пример и разд. 24.13.1.1.) и птеридинов (разд. 11.13.).
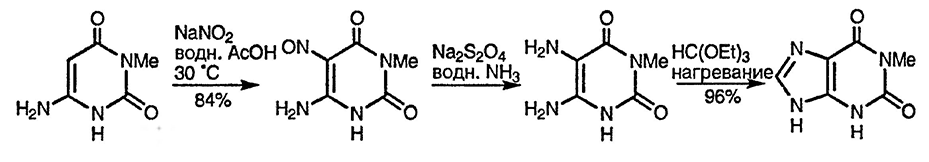
Глава 11
- 11. Диазины, пиридазины, пиримидины и пиразины: реакции и методы синтеза
- 11.1. Реакции с электрофильными реагентами
- 11.1.1. Присоединение по атому азота
- 11.1.1.1. Протонирование
- 11.1.1.2. Алкилирование
- 11.1.1.3. Окисление
- 11.1.2. Замещение при атоме углерода
- 11.1.2.1. Галогенирование
- 11.2. Реакции с окислителями
- 11.3. Реакции с нуклеофильными реагентами
- 11.3.1. Замещение атома водорода
- 11.3.1.1. Алкилирование и арилирование
- 11.3.1.2. Аминирование
- 11.3.2. Замещение других уходящих групп
- 11.4. Реакции с основаниями
- 11.4.1. Депротонирование при атоме углерода
- 11.4.2. Металлирование
- 11.5. Реакции С-металлированных диазинов
- 11.5.1. Литийорганические производные
- 11.5.2. Реакции, катализируемые палладием
- 11.6. Реакции с восстановителями
- 11.7. Реакции со свободными радикалами
- 11.8. Электроциклические реакции
- 11.9. N-оксиды диазинов
- 11.10. Оксидиазины
- 11.10.1. Строение оксидиазинов
- 11.10.2. Реакции оксидиазинов
- 11.10.2.1. Реакции с электрофильными реагентами
- 11.10.2.2. Реакции с нуклеофильными реагентами
- 11.10.2.3. Реакции с основаниями
- 11.10.2.4. Замещение атома кислорода
- 11.10.2.5. Реакции, катализируемые переходными металлами
- 11.10.2.6. Электроциклические реакции
- 11.11. Аминодиазины
- 11.12. Алкилдиазины
- 11.13. Четвертичные азиниевые соли
- 11.14. Синтез диазинов
- 11.14.1.1. Из 1,4-дикарбонильных соединений и гидразина
- 11.14.1.2. Реакцией циклоприсоединения 1,2,4,5-тетразина к производным ацетилена
- 11.14.1.3. С использованием других реакций циклоприсоединения
- 11.14.1.3.1. С использованием галогеносодержащих гидразонов
- 11.14.1.3.2. С использованием S,S-диоксидов тиофена
- 11.14.1.3.3. С использованием галогенозамещённых циклопропенов
- 11.14.2. Синтез пиримидинового кольца
- 11.14.2.1. Из 1,3-дикарбонильных соединений и соединений, содержащих фрагмент N-C-N
- 11.14.2.2. Реакцией циклоприсоединения 1,3,5-диазинов к производными ацетилена
- 11.14.2.3. Из 3-этоксиакрилоилизоцианата и первичных аминов
- 11.14.3. Синтез пиразинового цикла
- 11.14.3.1. Самоконденсацией 2-аминокетонов
- 11.14.3.2. Из 1,2-дикарбонильных соединений и 1,2-диаминов
- 11.14.3.3. Синтез пиразинов через сульфиды
- 11.14.4. Примеры некоторых важных синтезов диазинов
- 11.14.4.1. 4-Амино-5-циано-2-метилпиримидин
- 11.14.4.2. 4,6-Диамино-5-тиоформамидо-2-метилпиримидин
- 11.14.4.3. Карбоциклический бромвинилдезоксиуридин
- 11.14.4.4. Коелентеразин
- 11.14.4.5. 2,5-Диметил-3-н-пропилпиразин
- 11.15. Птеридины
Дополнительно:
 Методы и достижения в физико-органической химии
Методы и достижения в физико-органической химии Сборник содержит фундаментальные обзоры из двух широко известных зарубежных ...
В справочник включены сведения об органических стабилизаторах, ускорителях и ...
 Новые линейные полимеры
Новые линейные полимеры В книге рассмотрены новые типы линейных полимеров, содержащих в основной цепи ...
 Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. Менделеева В книге освещены предыстория периодического закона и его развитие на протяжении ...